Взагалі всі ненасичені спирти відносяться до класу спиртів, вони мають у своїй будові одну або більше відповідних функціональних гидроксогрупп. Відрізняє їх лише наявність в молекулі кратні (подвійні, потрійні) зв’язків. Таким чином ненасичені спирти поєднують в собі властивості і неграничних вуглеводнів, і звичайних спиртів.
Будова
Як правило, функціональна гидроксогруппа повинна знаходитися у насиченого (тобто тільки з одинарними зв’язками) атома вуглецю (атом вуглецю, що знаходиться поряд з функціональною групою з’єднання, називається альфа-вуглецем). Такі спирти володіють усіма стандартними властивостями своїх граничних сусідів. Найпростіший непредельный спирт з насиченим альфа-вуглецем – це алліловий спирт або пропендиол.
Енолы
Спирти з -OH групою, що знаходиться біля ненасиченого вуглецю, називаються енолами. Практично всі вони нестійкі і при утворенні майже відразу ж перегруповуються у відповідні кетони. Невелика частина, правда, залишається в первісному вигляді, проте вона зовсім невелика. У такому разі говорять про кето-енольной таутомерії: в речовині міститься одночасно два так званих таутомера: в одного атом водню знаходиться біля кисню, і це енол, а в іншого водень перемістився до вуглецю, і це вже кетон (карбонильное з’єднання).
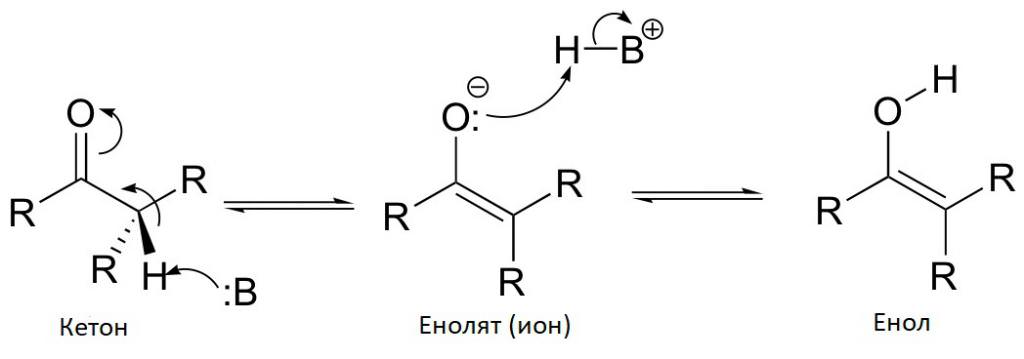
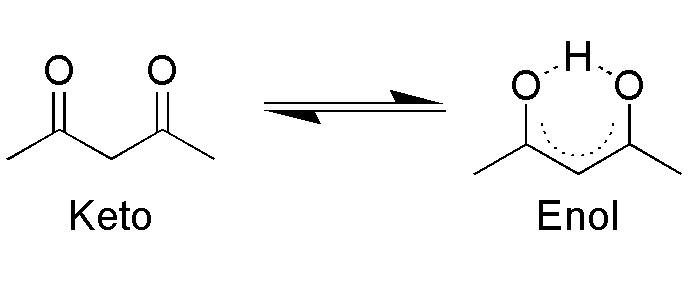
У більшості речовин подібної будови зміст еноли становить частки відсотка. Однак є деякі з’єднання, в яких за рахунок певних заступників у атома вуглецю, безпосередньо пов’язаного з киснем гидроксогруппы, можна домогтися відносної стабільності енола. Наприклад, в ацетилацетоне відсоток еноли-таутомерів досягає 76.
Перший в ряду еноли – це вініловий спирт. У кето-енольной таутомерії йому відповідає ацетальдегід.