Молекулярно-кінетична теорія газів
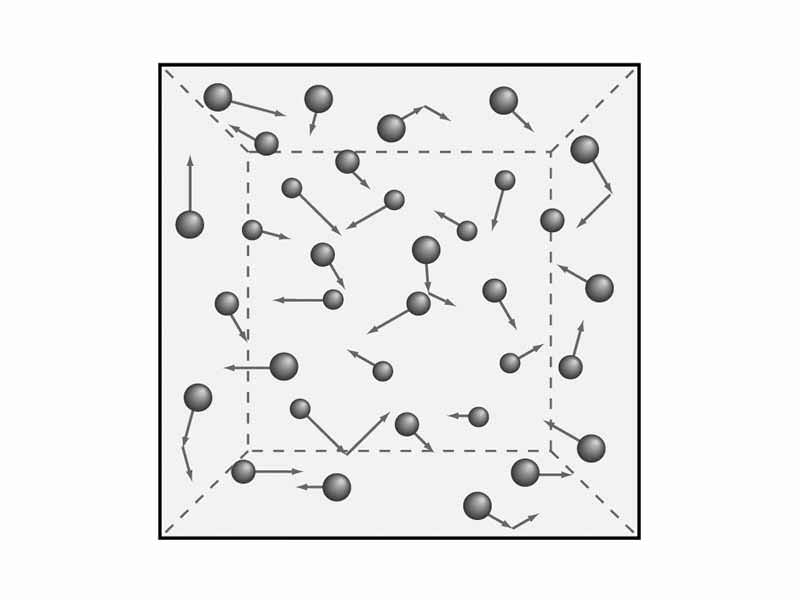
З’являється необхідність в розумінні положень газової теорії. Як ми говорили раніше, нами будуть розглянуті макроскопічні характеристики газів, наприклад, тиск і температура. Це знадобиться надалі для того, щоб вивести рівняння молекулярно-кінетичної теорії газів. Але математика – потім, а зараз займемося теорією і, відповідно, фізикою.
Вченими були сформульовані п’ять положень молекулярної теорії газів, які служать для осмислення кінетичної моделі газів. Вони звучать так:
П’яте положення ми з вами можемо переписати через такий вигляд рівняння молекулярно-кінетичної теорії газів:
Е=1/2*m*v^2=3/2*k*T,
де k – це постійна Больцмана; Т – температура в Кельвінах.
Це рівняння дає нам зрозуміти зв’язок між швидкістю елементарних частинок газу і їх абсолютною температурою. Відповідно, чим вище їх абсолютна температура, тим більше швидкість і кінетична енергія.