Тиск газів
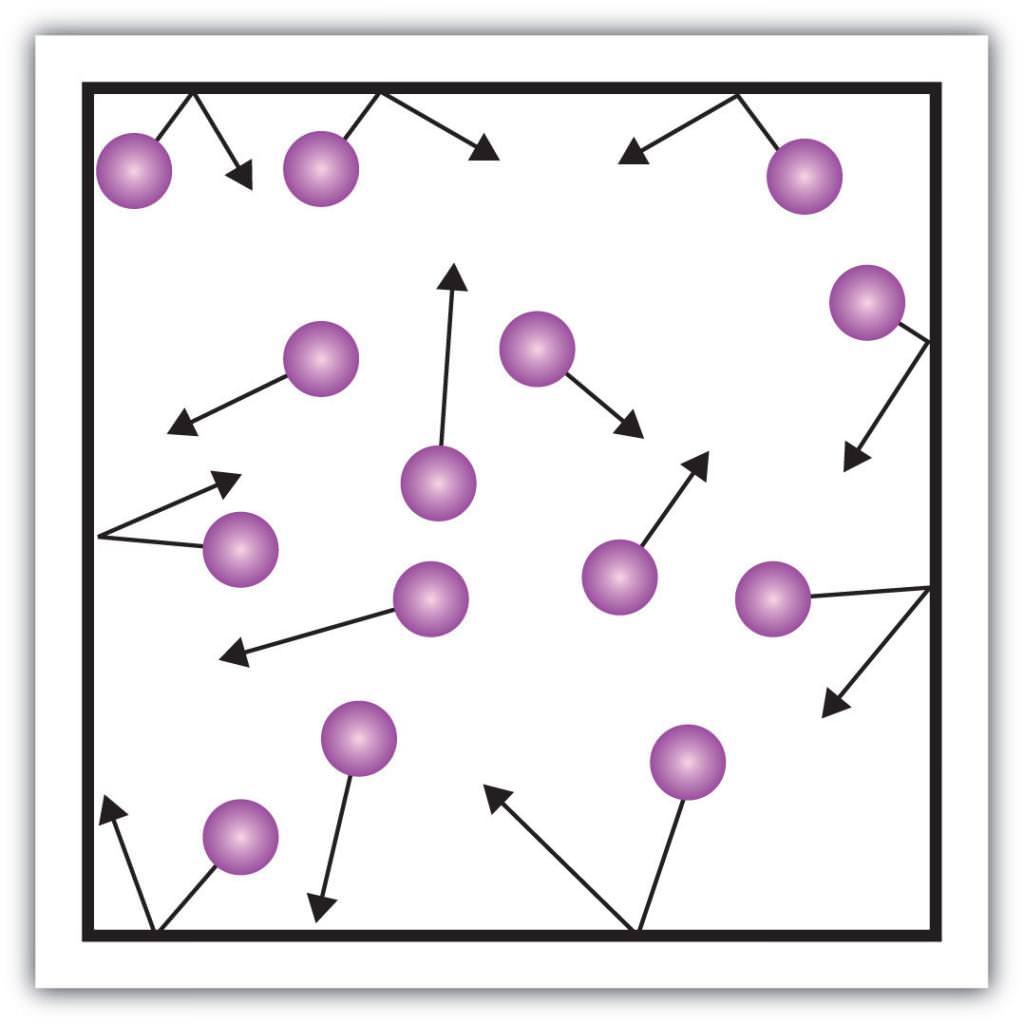
Такі макроскопічні складові характеристики, як, наприклад, тиск газів, що також можна пояснити з допомогою кінетичної теорії. Для цього наведемо такий приклад.
Припустимо, що молекула якогось газу знаходиться в ящику, довжина якого L. Скористаємося вищевикладеними положеннями газової теорії і врахуємо той факт, що молекулярна сфера рухається тільки по іксовій осі. Таким чином, ми зможемо спостерігати процес пружного зіткнення з однієї з стінок судини (ящика).
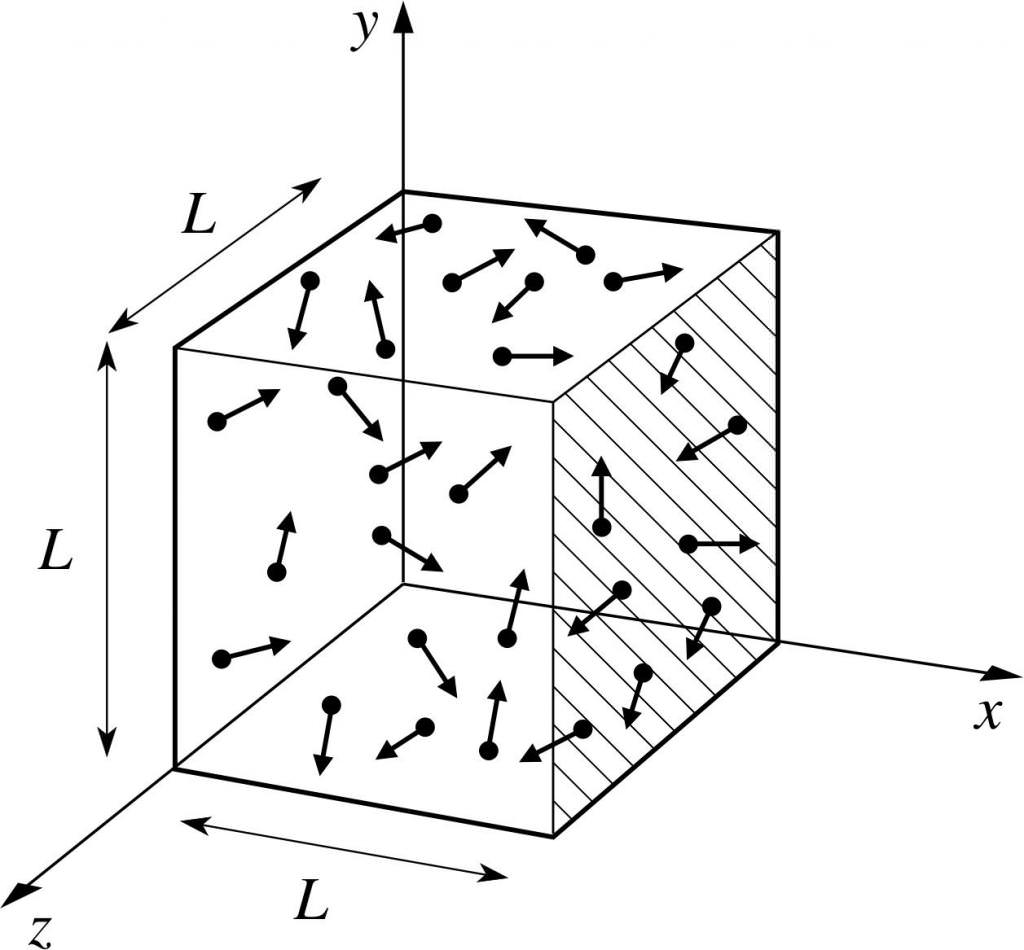
Імпульс відбувається зіткнення, як нам відомо, визначається формулою: p=m*v, але в даному випадку ця формула набуде проекційний вигляд: p=m*v(х).
Оскільки нами розглядається тільки розмірність осі абсцис, тобто осі х, то загальна зміна імпульсу буде виражена формулою: m*v(х) – m*(-v(х))=2*m*v(х).
Далі розглянемо силу, що надається нашим об’єктом за допомогою другого закону Ньютона: F=m*a=P/t.
З цих формул виразимо тиск з боку газу: P=F/a;
Тепер підставимо в отриману формулу вираження сили і отримаємо: P=m*v(х)^2/L^3.
Після цього нашу готову формулу тиску можна записати для N-го числа молекул газу. Іншими словами, вона матиме наступний вигляд:
P=N*m*v(х)^2/V, де v – швидкість, а V – об’єм.
Тепер спробуємо виділити кілька основних положень по тиску газу:
- Воно проявляється завдяки зіткнень молекул з молекулами стінок об’єкта, в якому він знаходиться.
- Величина тиску прямо пропорційна силі і швидкості наголоси молекул об стінки посудини.