При отриманні в промисловості різного виду алкілбензолів і ацилбензолов широке поширення одержала реакція Фріделя‒Крафтса. Вона є одним з двох відомих способів синтезу даних сполук, а її параметри піддаються регулюванню для досягнення більш високого виходу продукту.
Докладніше про способи алкілування аренів
Найвідомішим прикладом реакції Фріделя‒Крафтса є взаємодія хлористого метилу (CH3Cl) з бензолом (C6H6) в присутності хлористого алюмінію (AlCl3), де на виході отримують толуол (C7H9). Цю реакцію отримали в 1877 р. двоє вчених – Чарльз Фрідель і Джеймс Крафтс. Вона згодом стала однією з важливих складових для промислового виробництва алкіларенов.
Основним синтезом є взаємодія бензолу та його гомологів з будь-якими алкілгалогенідамі в присутності так званих кислот Льюїса. Суть від зміни реагентів не змінюється: реакція завжди проходить за одним і тим же принципом. Похідними цього способу стало отримання в органічній хімії алкілбензолів шляхом взаємодії спирту та неорганічної кислоти, карбониевого іона і ароматичного кільця.
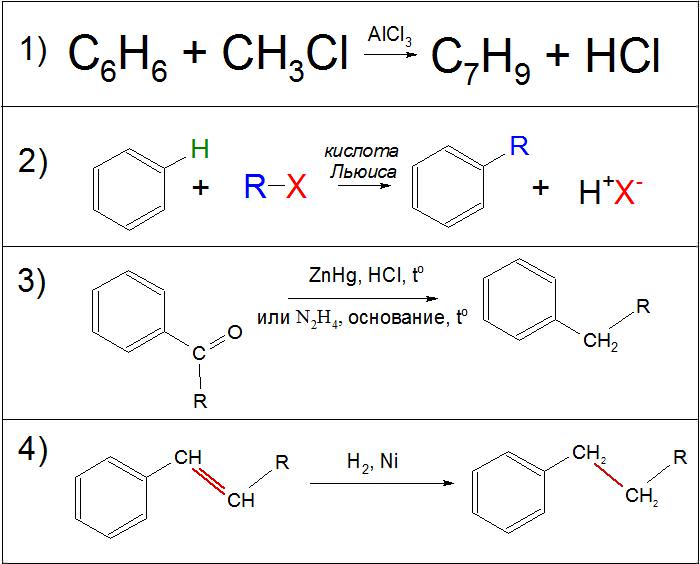
Другим способом вважають метод перетворення бічного ланцюга різних ароматичних кетонів в присутності амальгами цинку (ZnHg) з соляною кислотою (HCl) або гідразину (N2H2) з сильною основою. Обидві реакції носять відновний характер: перша називається реакцією Клемменсу, друга – за Кижнеру‒Вольфу.
Також якщо в бічний ланцюга знаходяться ненасичені зв’язки, їх можна відновити шляхом реакції на нікелевому каталізаторі (Ni) в присутності газоподібного водню (H2).
Механізми реакції
В літературі описують два можливі шляхи протікання реакції, і обидва вони проходять за принципом електрофільного заміщення. Різниця полягає лише в природі електрофени: у першому випадку це алкильный карбониевый іон (інша назва – карбокатион), що утворюється в результаті приєднання галоген-іона до кислоти Льюїса за донорно-акцепторної принципом, а в другому – одностадійне створення внутрішнього комплексу між усіма учасниками реагентами за тим же способом. Нижче детально розглянуто кожен з можливих варіантів.
Реакція з утворенням іона карбониевого
Даний механізм передбачає проходження синтезу в 3 стадії, де кислоти Льюїса, наприклад, AlCl3, TiCl4, SnCl4, FeCl3, BF3, HF виступають у якості каталізатора процесу.
Для розгляду типової реакції Фріделя-Крафтса було обрано взаємодія між бензолом і 1-фторпропаном (C3H6F) в присутності трифтористого бору BF3 як каталізатора.
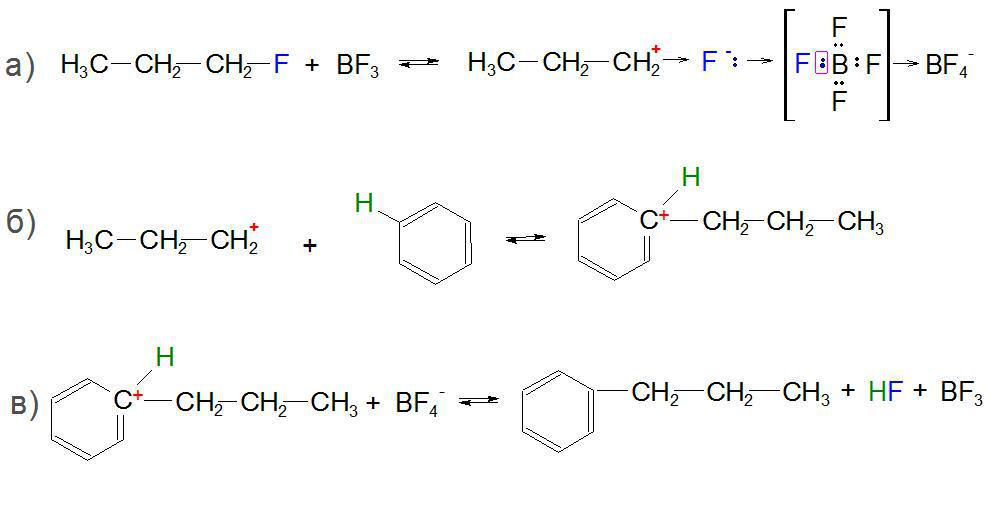
У першій стадії процесу C3H6‒F реагує з BF3, приєднуючи галоген-іон за донорно-акцепторної принципом. На зовнішньому енергетичному рівні у бору є вільна комірка (акцептор), яку займає фтор з неподіленої парою електронів (донор). Завдяки такому приєднання атом вуглецю C, що стоїть поруч з галогеном F в 1-фторпропане, здобуває позитивний заряд і стає дуже реакционноспособным пропіл-карбониевым іоном. Це властивість даних іонів збільшується в ряду первинний→ вторинний→ третинний, тому в залежності від умов в продуктах реакції алкілування можлива перегрупування бічного ланцюга у більш вигідне становище.
Далі, отриманий карбокатион реагує з бензолом і приєднується в місці зв’язку атомів вуглецю і водню, передаючи електронну щільність на C ароматичного кільця.
У третій стадії новоутворена частка реагує з іонізованою кислотою Льюїса, де атом H відщеплюється від арена і приєднується до ісмаелю, який відірвався F з утворенням фтороводень HF, а продуктами реакції стає н-пропилбензол, изопропилбензол і відновлений BF3.
Синтез з утворенням внутрішнього комплексу
Механізм реакції передбачає утворення проміжного загального комплексу, де в одну стадію алкильная група переміщається від галогену до ароматичного кільця, а галоген до кислоти Льюїса, створюючи при цьому іонну пару, яка розпадається на алкилбензол, мінеральне з’єднання і відновлений каталізатор.
Види похідних реакцій
Реакція Фріделя‒Крафтса для бензолу і його гомологів зі спиртами в присутності мінеральних кислот проходить за тими ж механізмами. В цьому випадку атом водню приєднується до гідроксид-йону і, відриваючись, утворює молекулу води. Утворився карбониевый іон прикріплюється до вуглецю в ароматичному кільці за місцем зв’язку з H. Цей відщеплюється атом, приєднуючись до кислотного залишку, а в результаті синтезується алкилбензол.
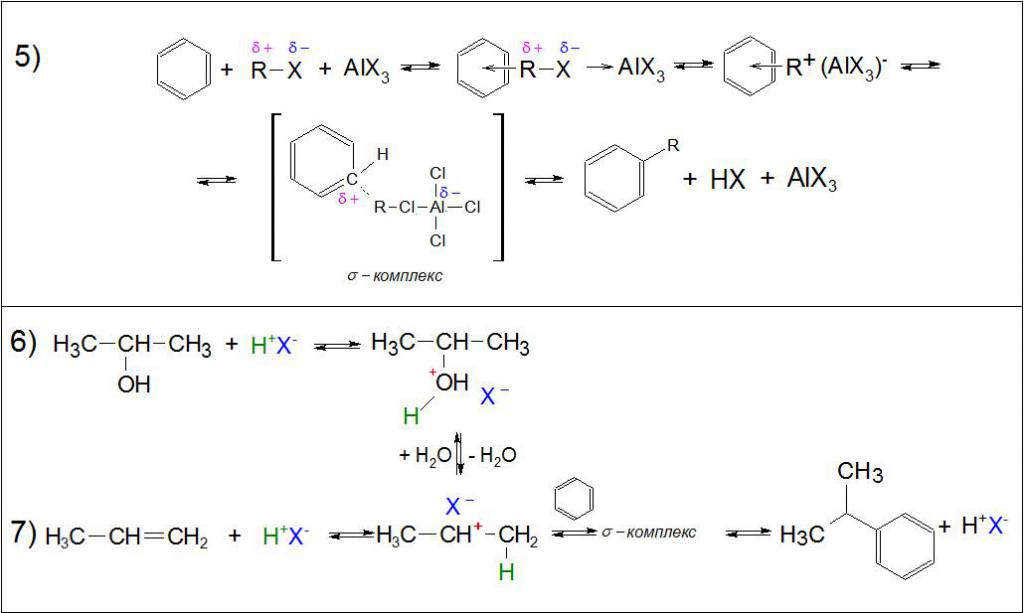
У ненасичених вуглеводнів за місцем подвійного зв’язку встає відірвався водень, утворюючи все той же карбокатион, пов’язаний з кислотним залишком. Гідрування алкена проходить біля того атома вуглецю, який утворює найбільш вигідну структуру. Потім реакція проходить як у попередньому випадку.
Одним з похідних синтезів також є реакція ацилування по Фриделю-Крафтсу, де замість алкилгалогенидов використовуються хлорангидриды (RCOCl) з утворенням ароматичних кетонів.
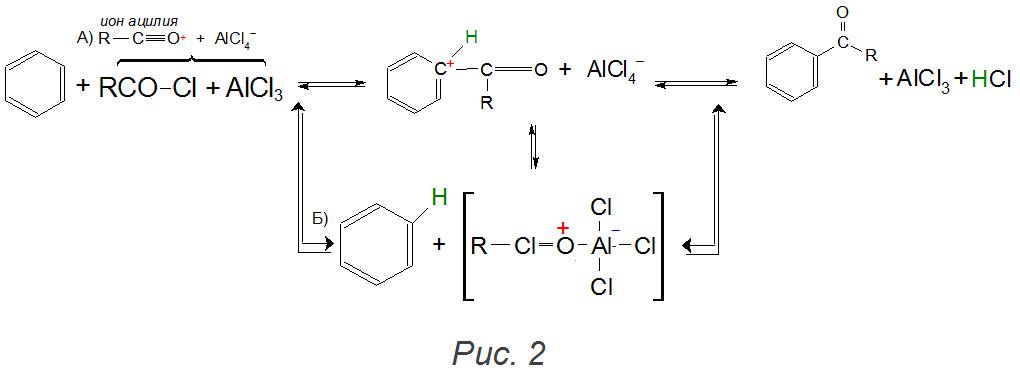
Приєднання двох і більше алкільних залишків
Бензол в реакції Фріделя-Крафтса може приєднувати від 2 до 6 заступників. Варто відзначити, що з кожним разом взаємодія проходить швидше, так як зв’язок в ароматичному кільці послаблюється вже при першому синтезі. Процес утворення полиалкилбензолов може здійснюватися в ході однієї реакції, тому для контролю отримання необхідного продукту користуються надлишком ароматичної сполуки. За допомогою цього способу можна поступово вводити по одній групі в структуру бензолу і його гомологів.
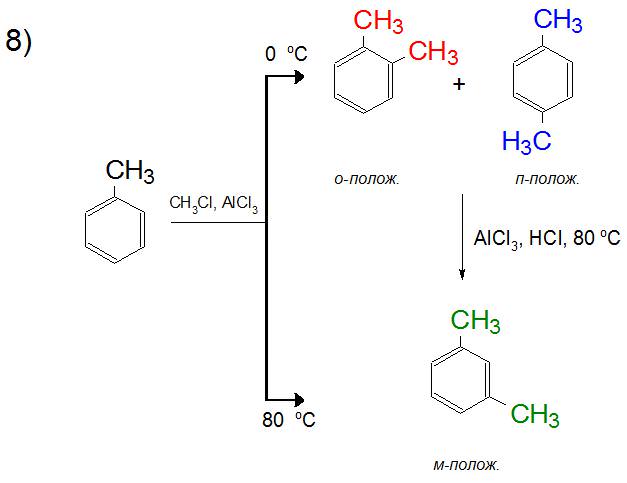
В реакції Фріделя-Крафтса толуол легко приєднує наступну алкільних груп, так як арен вже був активований по відношенню до электрофильному заміщення. В продуктах реакції при 0 °C буде рівноважна суміш орто – і пара-ксилолу, а при підвищенні температури до 80 °C синтезуватися буде, в основному, тільки мета-з’єднання. Це пояснюється, як буде описано нижче, енергетичної вигодою освіти тих чи інших положень в залежності від нагрівання суміші.

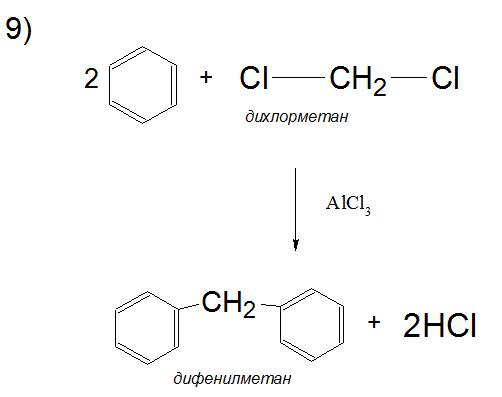
Продовженням цього синтезу є можлива здатність полигалогеналканов приєднувати більше одного ароматичного кільця з основного механізму.
Особливості синтезу
В органічній хімії освіта суміші ізомерів алкілбензолів пояснюється двома причинами. По-перше, як було сказано вище, освіта карбокатиона іноді передбачає більш вигідну перегрупування, за рахунок чого і утворюються різні структури продукту. По-друге, їх кількісний склад регулюється температурним режимом (від 0 °C до 80 °C), тобто при підвищенні температури з метою компенсації енерговитратності освіти конкретної структури можна домогтися більш високого виходу одного з ізомерів. Цей же принцип діє і при утворенні диалкилбензолов, де орто – і пара-положення при підвищенні температури поступаються мета-орієнтації.
Обмеження в застосуванні синтезу
Існують 3 нюансу, з-за яких реакція Фріделя‒Крафтса може йти з побічними ефектами або ж не йти зовсім.
Введення электродефицитных заступників в ароматичне кільце супроводжується дезактивацією арена по відношенню до подальших реакцій заміщення. Так, наприклад, при приєднанні іона нитрония до алкилбензолам синтез проходить важче, так як він відтягує електронну щільність на себе із-за прагнення азоту заповнити порожню комірку на зовнішньому енергетичному рівні. З цих же міркувань, полинитрование або, наприклад, полисульфирование проходить при дуже жорстких умовах, так як з кожним наступним синтезом ароматичне кільце втрачає реакційну здатність.
Тому синтез по Фриделю-Крафтсу не йде, якщо в ароматичному кільці є электродефицитные заступники, в особливості, мають сильноосновные властивості, зв’язують кислоти Льюїса (наприклад -NH2, –NHR, -NR2). А ось реакції, наприклад, з галогенбензолами або ароматичними карбоновими кислотами йдуть по типовому механізму, хоча вони і володіють меншою реакційною здатністю.
Важливим моментом також є перегрупування карбониевого іона в процесі або ж продукту в кінці, так як на неї справляє великий вплив умови проведення синтезу, зокрема, температура і надлишок алкилируемого речовини.
Замість алкилгалогенидов R‒X (R = алкильная група, X = галоген) не можна використовувати галогенарены Ar‒X (Ar = ароматичне з’єднання), так як вони дуже важко вступають в реакцію відщеплення заступника навіть під впливом кислот Льюїса.