Підгрупа азоту посідає п’яту групу (головну підгрупу) в таблиці Дмитра Івановича Менделєєва. У неї входить декілька елементів, кожен з яких заслуговує детального вивчення і розгляду.

Коротка характеристика
Азот є найважливішим складовим елементом земної атмосфери (78% від об’єму). В біосфері він входить до складу білкових молекул, вважається основним елементом для утворення життя на нашій планеті. У літосфері елементи підгрупи азоту зустрічаються у вигляді нітратів, фосфатів.
Природний азот являє собою сукупність двох ізотопів:
- 99,635% маси становить N 14;
- 0,365% маси включає 15 N.
Фосфор вважається складовим компонентом живих організмів. У природі він знаходиться у вигляді фосфатів (мінералів).
Вісмут, сурма, миш’як широко зустрічаються в природі в складі сульфідних руд. Миш’як – це важливий елемент, який відповідає за ріст волосся. Його сполуки отруйні, в невеликих дозах застосовуються у ветеринарії та медицині.
Фосфор затребуваний в авіації, сільському господарстві, медицині.
Особливості будови атомів
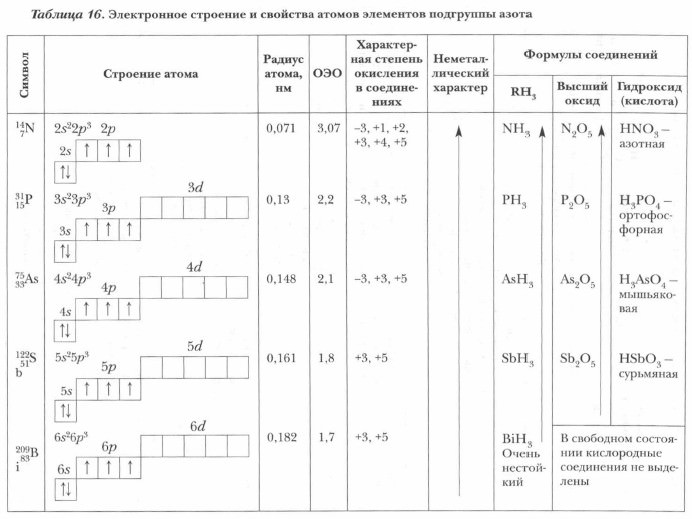
Підгрупа азоту містить на останньому енергетичному шарі п’ять валентних електронів. Представники даної групи можуть віддавати їх в ході хімічних взаємодій або приймати від інших атомів три електрона, завершуючи зовнішній енергетичний рівень. Саме тому підгрупа азоту має ступінь окислення від -3 до +5. Вищі оксиди виявляють кислотний характер, мають загальну формулу R2 O5.
Підгрупа азоту утворює летючі водневі сполуки складу RH3.
Зміна властивостей
Елементи аналізованої підгрупи виявляють неметалічні властивості. Їх здатність притягувати електрони нижче, ніж у представників підгрупи халькогенов і галогенів. Чим ще відрізняється підгрупа азоту? Властивості металевого характеру (відновна здатність) зростають від азоту до висмуту, так як зростає радіус атома.

Фізичні властивості
Фосфор і азот є типовими неметалами, сурма і миш’як виявляють двоїсті властивості, а вісмут – це типовий метал. Практична підгрупа азоту має типові фізичні властивості. Азот – газоподібна речовина молекулярної будови, без смаку, запаху, добре розчинний у воді. Фосфор, що володіє тетраэдрическое будова, є м’яким твердим речовиною, що мають незначну розчинність у воді.
Миш’як – це тверда речовина, що має на зламі металевим блиском. Дане з’єднання нерозчинна у воді, має несуттєвою провідністю електричного струму.
Вісмут – рожево-біле, кристалічна, крихка речовина, яка має несуттєвою електропровідністю.

Характеристика азоту
Саме цим хімічним елементом починається підгрупа азоту. Загальна характеристика даного елемента повинна починатися з того, що він проявляє яскраво виражені неметалічні властивості. Тільки азот не здатний збільшувати свої валентності. У нього сім електронів, які розташовуються на двох енергетичних рівнях. На зовнішньому рівні розташовується п’ять електронів, тому азот здатний виявляти наступні ступені окислення: – 3,+5,-2,-1,+1,+2,+3,+4.
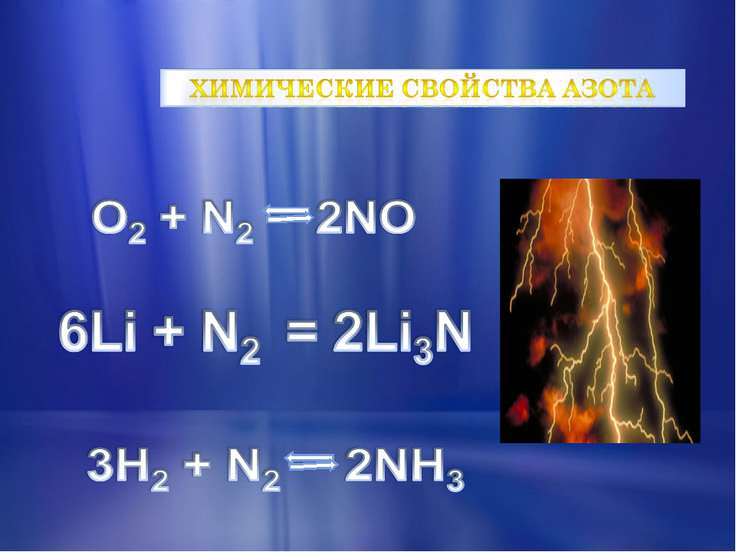
При нормальних умовах азот є молекулярним, малоактивним, газоподібною речовиною. Ця двухатомная молекула не вступає в реакцію з киснем, трохи легший за повітря. При стисненні азот перетворюється в снегообразную масу. Даний газ не підтримує горіння, дихання. При кімнатній температурі він здатний взаємодіяти лише з літієм, утворюючи його нітрид.
Щоб розірвати молекулу азоту, потрібно витратити 942 кДж/моль енергії. Всі хімічні взаємодії, учасником яких стає молекулярний азот, пов’язані із зміною ступенів окиснення, причому азот здатний виявляти властивості і відновника, і окислювача.
При нагріванні він здатний взаємодіяти з металами. При високій температурі реагує з деякими неметалами.
Якби азот вступав у взаємодії при кімнатній температурі, він би утворював з киснем повітря оксиди, що зробило б неможливим існування на землі живих організмів.
Використання азоту
В промисловості його одержують з повітря, застосовуючи відміну температур кипіння кисню і азоту. Ця речовина використовується в хімічній промисловості для синтезу аміаку, одержання сечовини. Він потрібен і для створення електричних ламп, сушінні вибухових сполук, перекачуванню горючих рідин. Підгрупа азоту і фосфору характеризується сполуками, затребуваними в різних галузях промисловості. Зупинимося на деяких з них.

Аміак
Його можна вважати найважливішим водневим з’єднанням азоту, що мають велике практичне значення. Бактерії переробляють молекули азоту в аміак. Це безбарвний газ, який має різким запахом. Він істотно легше за повітря, добре розчиняється у воді. В окислювально-відновних процесах він проявляє відновні властивості. Аміак взаємодіє з киснем, утворюючи чистий азот або оксид азоту (2), а з неорганічними кислотами утворює солі амонію. Вони потрібні для виготовлення вибухових речовин, электробатарей.
Його застосовують для виготовлення азотної кислоти і азотовмісних мінеральних сполук. У рідкому вигляді він використовується в холодильній промисловості. У медицині він необхідний для виготовлення нашатирного спирту, а в побуті служить відмінним засобом для виведення плям.
Оксиди азоту
П’ята група і підгрупа азоту характеризується можливістю утворювати відразу кілька видів оксидів. Наприклад, азот утворює цілу групу сполук з киснем.
Бурий газ (оксид азоту (IV) – це газоподібне з’єднання, що володіє специфічним запахом. Речовина розчиняється у воді, має властивості кислотного оксиду, при нагріванні розпадається, отруйна.
Азотний ангідрид (оксид азоту V) – це кристалічна сполука білого кольору. При нагріванні речовина розкладається, проявляє отруйні властивості.

Азотна кислота та її солі
Підгрупа азоту, підгрупа вуглецю характеризуються утворенням гідроксидів, які мають кислотні властивості.
В молекулі азотної кислоти знаходиться три елементи, між якими існують ковалентні полярні зв’язку. Дане молекулярне з’єднання, в якому азот проявляє максимальну ступінь окислення (+5) при валентності IV, є безбарвною рідиною, димлячої на повітрі, має їдким запахом.
У концентрованої азотної кислоти жовтий колір. Її щільність становить 1,51 г/см3. Вона розчиняється у воді, проявляє властивості сильного електроліту.
У розведеному вигляді у азотної кислоти такі ж хімічні властивості, що і в інших мінеральних кислот. При кімнатній температурі азотна кислота розпадається на бурий газ і воду, тому зберігають з’єднання в прохолодному темному місці.
Концентрована кислота руйнує органічні речовини, вона здатна вступати у взаємодію навіть з металами, які розташовуються в ряду напруг металів після водню.
Нітрати (солі азотної кислоти) отримують при взаємодії кислоти з металами, підставами, основними оксидами, аміаком. Вони є твердими речовинами, що мають гарну розчинність у воді, є сильними електролітами.
При підвищенні температури відбувається розкладання нітратів. Якісною реакцією на нітрат-іон є взаємодія з мідними стружками (в присутності концентрованої сірчаної кислоти). Ознакою процесу є виділення бурого газу.
Тверді солі визначають шляхом внесення їх у полум’я спиртівки. Яскравий спалах є підтвердженням присутності нітрату, так як є вибуховими сполуками.

Висновок
Серед елементів, що входять у підгрупу нітрогену, інтерес представляє і фосфор. У нього більший радіус атома, тому неметалічні властивості проявляються слабше. Даний хімічний елемент проявляє ступені окислення 3,+3,+5. У вільному вигляді фосфор здатний утворювати кілька аллотропних модифікацій: червоний, білий, чорний. У хімічних взаємодіях він виявляє окисні і відновні властивості. Наприклад, у білого фосфору кристалічна решітка молекулярна, це речовина світиться в темряві, є сильною отрутою.
Червоний фосфор не розчиняється у воді, при нагріванні до температури плавлення, він переходить в іншу алотропні модифікації.
Чорний фосфор має напівпровідниковими властивостями, він важче інших аллотропних форм, зовні схожий з графітом.
Серед сполук, які утворює фосфор, інтерес представляють його оксиди.
Так, оксид фосфору (V) володіє гігроскопічністю, тому застосовується в хімічній промисловості для осушування газоподібних сполук.
При цьому він перетворюється на аморфну масу – HPO3. У разі кип’ятіння з оксиду фосфору (V) утворюється фосфорна кислота. H3PO4 є білою кристалічною речовиною, добре розчинним у воді. Дана сполука відноситься до сильних електролітів.
Велика кількість фосфору витрачається на виготовлення запалювальних снарядів, бомб, димових шашок. Солі фосфорної кислоти застосовуються в сільському господарстві в якості мінеральних добрив. У всіх елементів п’ятої групи головної підгрупи) на зовнішньому рівні міститься однакова кількість електронів, що можна вважати загальним ознакою.