Під рівновагою зазвичай розуміють особливий стан системи або тіла, коли всі надані на неї впливу компенсують один одного. Або ж відсутні взагалі. У хімії ж застосовують поняття рівноваги до реакцій, що відбуваються між різними речовинами, а точніше, до умов їх протікання.
Поняття рівноваги
Хімічні реакції мають безліч класифікацій за різними ознаками, але, говорячи про хімічному рівновазі, що таке оборотні й необоротні реакції слід згадати.

Якщо в результаті реакції утворюються продукти, які не взаємодіють один з одним, говорять про незворотних реакціях, тобто вони йдуть тільки в прямому напрямку. Зазвичай у них одним із продуктів є газоподібний, мало диссоциирующее або нерозчинну сполуку. Наприклад:
Pb(NO3)2 + 2ΗCl PbCl2↓ + 2HNO3
Na2CO3 + 2ΗCl 2NaCl + CO2↑ + Η2O
NaOΗ + ΗCl NaCl + Η2O
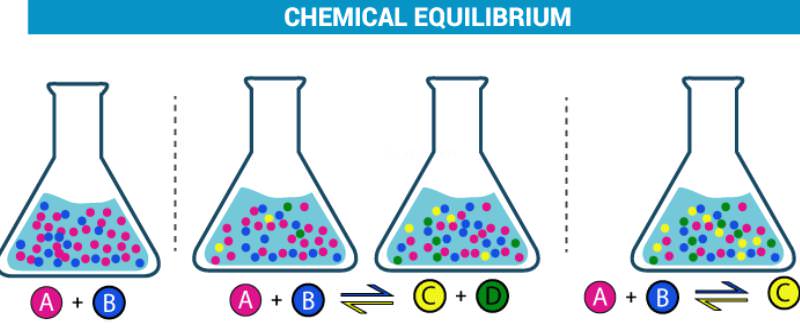
Продукти оборотних реакцій здатні взаємодіяти один з одним, утворюючи при цьому вихідні речовини, тобто одночасно відбуваються два протилежно спрямовані реакції. Якщо в якийсь момент часу при визначених умовах швидкість прямої реакції буде дорівнювати швидкості зворотного, то встановлюється хімічна рівновага.
Слід згадати, що така рівновага характеризується як динамічний. Іншими словами, обидві реакції тривають, але значення концентрацій всіх її учасників залишаються незмінними і називаються рівноважними.
Математично це стан висловлюють з використанням константи рівноваги (Кр). Нехай відбувається взаємодія речовин, що описується рівнянням аА + bB cc + dD. Для протилежних реакцій можна записати формули розрахунку їх швидкостей через закон діючих мас. Оскільки у стані рівноваги швидкості ці будуть рівні, то можна виразити відношення констант швидкостей двох протилежних реакцій. Ось воно-те й буде чисельно дорівнювати константі рівноваги.

Значення Кр допомагає визначити повноту протікають реакцій. Якщо Кр<1, то реакція у прямому напрямку майже не протікає. Якщо Кр>1, то рівновага зсунута до продуктів.
Види рівноваги
Хімічна рівновага буває істинним, удаваним і хибним. Для істинного рівноваги спостерігаються ознаки:
- Якщо відсутній зовнішній вплив, то воно незмінне в часі.
- Якщо зовнішні впливи змінюються (це стосується температури, тиску та ін), то стан системи змінюється. Але варто тільки повернути початкові значення умов, рівновагу відразу ж відновлюється.
- Стану істинного рівноваги можна досягти як з боку продуктів хімічної реакції, так і від вихідних речовин.
Якщо не виконується хоча б одна з цих умов, то говорять, що така рівновага є удаваним (метастабільним). Якщо ж стан системи починає змінюватися необоротно при зміні зовнішніх умов, то таку рівновагу називають хибним (або загальмованою). Прикладом останнього є реакція заліза з киснем.

Поняття рівноваги дещо відрізняється з точок зору термодинаміки та кінетики. Під термодинамічним рівновагою розуміється мінімальне значення енергії Гіббса для конкретної системи. Справжнє рівновага характеризується ΔG = 0. А про стан, для якого швидкість прямої та зворотної реакцій зрівняні, тобто v1 = v2, кажуть, що таке рівновага – кінетичне.
Принцип Ле-Шательє
Дослідженням закономірностей зміщення рівноваги займався Анрі Ле-Шательє в 19 столітті, однак узагальнив усі ці праці і сформулював принцип рухомого рівноваги пізніше Карл Браун:
якщо на рівноважну систему, подіяти ззовні, то рівновага буде зміщуватися в напрямку зменшення впливу виробленого
Іншими словами, якщо на рівноважну систему виявляється якийсь вплив, вона прагне змінитися таким чином, щоб цей вплив був мінімальним.
Зміщення рівноваги
Слідства з принципу Ле-Шательє розглянемо на прикладі рівняння реакції:
N2 + 3Η2 2NΗ3 + Q.
Якщо збільшити температуру, то зміститься рівновага в бік ендотермічної реакції. В даному прикладі теплота виділяється, значить пряма реакція екзотермічна, а рівновага зміститься до вихідних речовин.
Якщо збільшити тиск, то це призведе до зміщення рівноваги до менших об’ємів газоподібних речовин. У наведеному прикладі є 4 моля газоподібних вихідних речовин і 2 моля газоподібних продуктів, отже, рівновага зміститься до продуктів реакції.
Якщо збільшити концентрацію вихідної речовини, то рівновага зміститься в напрямку прямої реакції і навпаки. Таким чином, якщо збільшити концентрації N2 або Η2, то рівновага зміститься в прямому напрямку, а якщо аміаку – у зворотному.