Окремі елементи основ хімічної термодинаміки починають розглядати ще в середній школі. На уроках хімії учні вперше стикаються з такими поняттями, як зворотні та незворотні процеси, хімічну рівновагу, тепловий ефект і багатьма іншими. Зі шкільного курсу фізики вони дізнаються про внутрішньої енергії, праці, можливостях і навіть знайомляться з першим началом термодинаміки.

Визначення термодинаміки
Студенти вузів і ссузів хіміко-технологічних спеціальностей детально вивчають термодинаміку в рамках фізичної та/або колоїдної хімії. Це один з основних предметів, розуміння якого дозволяє виконувати розрахунки, необхідні для розробки нових технологічних ліній виробництва та обладнання для них, вирішення проблем у вже наявних технологічних схемах.
Хімічної термодинамікою прийнято називати один з розділів фізичної хімії, що вивчає хімічні макросистеми і пов’язані з ними процеси на основі загальних законів про перетворення теплоти, роботи і енергії один в одного.
Вона заснована на трьох постулатах, які частіше називають початки термодинаміки. Вони не мають математичної основи, а базуються на узагальненні дослідних даних, які накопичені людством. З цих законів виведені численні слідства, покладені в основу опису навколишнього світу.
Завдання
До основних завдань хімічної термодинаміки можна віднести:
- доскональне вивчення, а також пояснення найважливіших закономірностей, які визначають напрямок хімічних процесів, швидкості їх протікання, умови, що роблять на них вплив (середа, домішки, випромінювання тощо);
- розрахунок енергетичного ефекту будь-якого хімічного або фізико-хімічного процесу;
- виявлення умов максимального виходу продуктів реакції;
- визначення критеріїв стану рівноваги різних термодинамічних систем;
- встановлення необхідних критеріїв для мимовільного протікання того або іншого фізико-хімічного процесу.

Предмет і об’єкт
Даний розділ науки не ставить перед собою мети пояснити природу або механізм якого-небудь хімічного явища. Її цікавить виключно енергетична сторона процесів. Тому предметом хімічної термодинаміки можна назвати енергію і закони перетворення енергії під час хімічних реакцій, розчиненні речовин при випаровуванні і кристалізації.
Ця наука дає можливість судити про те, чи здатна протікати та чи інша реакція в певних умовах саме з енергетичної сторони питання.
Об’єктами її вивчення називають теплові баланси фізико-хімічних процесів, фазові переходи і хімічні рівноваги. Причому лише в макроскопічних системах, тобто таких, що складаються з величезного числа частинок.
Методи
Термодинамічний розділ фізичної хімії для вирішення основних своїх завдань користується теоретичними (розрахунковими) і практичними (експериментальними) методами. Перша група методів дозволяє кількісно зв’язати різні властивості, і розрахувати одні з них, грунтуючись на досвідчених величинах інших, користуючись принципами термодинаміки. Закони квантової механіки допомагають встановити способи опису та особливості руху частинок, зв’язати величини, що характеризують їх, з фізичними параметрами, заданими в ході дослідів.
Дослідницькі методи хімічної термодинаміки ділять на дві групи:
- Термодинамічні. Вони не враховують природу конкретних речовин, не базуються ні на яких модельних уявленнях про атомно-молекулярну будову речовин. Такі методи прийнято називати феноменологічними, тобто встановлюють зв’язки між спостережуваними величинами.
- Статистичні. Вони ґрунтуються на будову речовини та квантових ефектах, дозволяють описувати поведінку систем, спираючись на аналіз процесів, що відбуваються на рівні атомів і їх складових частинок.

Обидва ці підходи мають свої переваги і недоліки.
|
Метод |
Переваги |
Недоліки |
|
Термодинамічний |
У зв’язку з великою спільністю досить простий і не вимагає додаткових відомостей, при цьому вирішує конкретні завдання |
Не розкриває механізм процесу |
|
Статистичний |
Допомагає зрозуміти суть і механізм явища, оскільки заснований на уявленнях про атомах і молекулах |
Вимагає ґрунтовної підготовки і великого обсягу знань |
Основні поняття хімічної термодинаміки
Система – це будь-який матеріальний макроскопічний об’єкт вивчення, відокремлений від зовнішнього середовища, причому межа може бути як реальною, так і уявною.
Типи систем:
- закрита (замкнута) – характеризується сталістю загальної маси, не відбувається обміну речовиною з зовнішнім середовищем, однак енергетично обмін можливий;
- відкрита – обмінюється з навколишнім середовищем і енергією, і речовиною;
- ізольована – не обмінюється з зовнішнім середовищем ні енергією (теплотою, роботою), ні речовиною, при цьому має постійний обсяг;
- адіабатично-ізольована – не має тільки теплового обміну з зовнішнім середовищем, але може бути пов’язана з нею роботою.
Для позначення способу обміну енергією і речовиною використовують поняття теплових, механічних і дифузійних контактів.
Параметрами стану системи називають будь-які вимірювані макрохарактеристики стану системи. Вони можуть бути:
- інтенсивними – не залежать від маси (температура, тиск);
- екстенсивними (накопичувальними) – пропорційними масі речовини (обсяг, теплоємність, маса).
Всі ці параметри запозичені хімічної термодинамікою у фізики і хімії, але мають дещо інший зміст, оскільки розглядаються в залежності від температури. Саме завдяки цій величині різні властивості зв’язуються між собою.
Рівноважним називають такий стан системи, в яке вона приходить при сталості зовнішніх умов і характеризується тимчасовим постійністю термодинамічних параметрів, а також відсутністю в ній речових і теплових потоків. Для даного стану спостерігається сталість тиску, температури і хімічного потенціалу у всьому обсязі системи.
Рівноважні та нерівноважні процеси
У системі основних понять хімічної термодинаміки особливе місце займає термодинамічний процес. Його визначають як зміни в стані системи, які характеризуються змінами одного або декількох термодинамічних параметрів.
Зміни в стані системи можливі при різних умовах. У зв’язку з цим розрізняють рівноважні та нерівноважні процеси. Рівноважний (або квазистатический) процес розглядається як ряд рівноважних станів якої-небудь системи. При цьому всі параметри її змінюються нескінченно повільно. Для протікання такого процесу необхідно дотримання ряду умов:
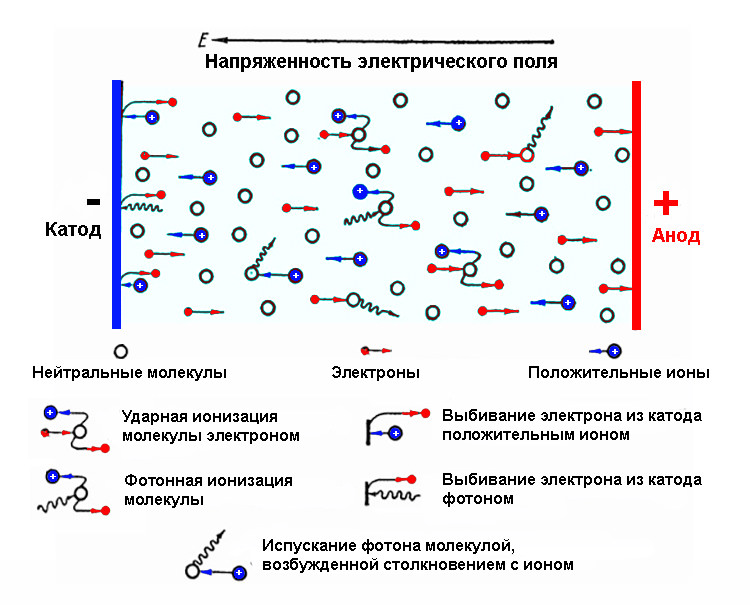
Процес зміни нерівноважного стану системи на рівноважний називають релаксацією, а тривалість його – часом релаксації. У хімічній термодинаміці найчастіше приймають найбільше значення часу релаксації для якого-небудь процесу. Пов’язано це з тим, що реальні системи легко виходять із стану рівноваги виникають потоками енергії та/або речовини в системі і є нерівноважними.
Оборотні і необоротні процеси
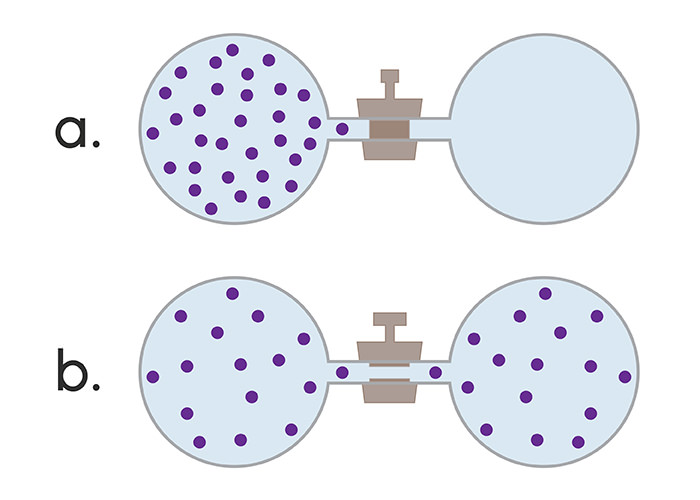
Оборотним термодинамічним процесом називають перехід системи з одного стану в інший. Він може протікати не тільки в прямому напрямку, але і у зворотному, причому через ті самі проміжні стани, при цьому змін у навколишньому середовищі спостерігатися не буде.
Незворотнім називають процес, для якого неможливий перехід системи з одного стану в інше, не супроводжується змінами в навколишньому середовищі.
Необоротними процесами є:
- теплопередача при кінцевої різниці температур;
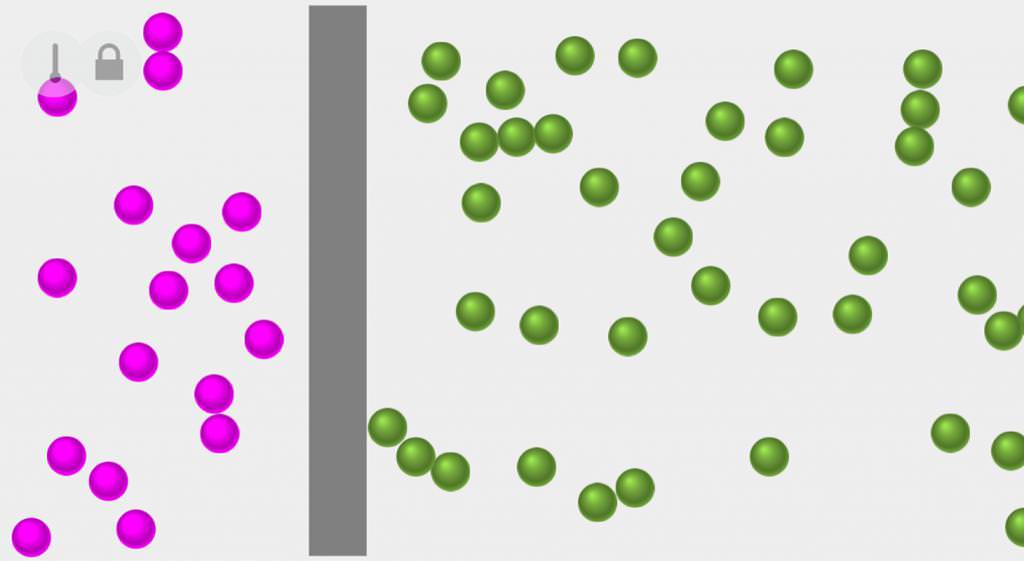
- розширення газу в вакуумі, оскільки при ньому не відбувається робота, а стиснути газ без її здійснення неможливий;
- дифузія, так як після видалення гази легко будуть взаємно дифундувати, а зворотний процес без здійснення роботи неможливий.
Інші види термодинамічних процесів
Круговим процесом (циклом) називають такий процес, в ході якого система характеризувалася зміною своїх властивостей, а в його кінці повернулася до вихідних значень.
Залежно від значень температури, об’єму і тиску, які характеризують процес, в хімічній термодинаміці розрізняють наступні його види:
- Ізотермічний (T = const).
- Изобарический (P = const).
- Изохорический (V = const).
- Адіабатичний (Q = const).
Закони хімічної термодинаміки
Перш ніж розглядати основні постулати, необхідно згадати суть величин, що характеризують стан різних систем.
Під внутрішньою енергією системи U розуміють запас її енергії, що складається з енергій руху і взаємодії частинок, тобто всіх видів енергії за винятком кінетичної енергії та її потенційної енергії положення. Визначити її зміна ∆U.
Ентальпію Н часто називають енергією розширеної системи, а також її теплосодержанием. H=U+pV.

Теплотою Q називають неупорядковану форму передачі енергії. Внутрішня теплота системи вважається позитивною (Q > 0), якщо тепло поглинається (ендотермічний процес). Негативна (Q < 0) вона в тому випадку, якщо тепло виділяється (екзотермічний процес).
Роботою А називають упорядковану форму передачі енергії. Вона вважається позитивною (A>0), якщо здійснюється системою проти зовнішніх сил, і негативною (A<0), якщо здійснюється зовнішніми силами над системою.
Основним постулатом є перший початок термодинаміки. Існує безліч його формулювань, серед яких можна виділити наступну: “Перехід енергії з одного виду в інший відбувається в строго еквівалентних кількостях”.
Якщо система здійснює перехід із стану 1 в стан 2, супроводжується поглинанням теплоти Q, яка, в свою чергу, витрачається на зміну внутрішньої енергії ∆U і здійснення роботи А, то математично цей постулат записується рівнянням: Q=∆U+A, або δQ = dU + δA.
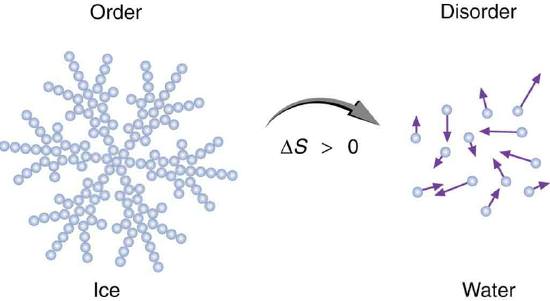
Другий закон термодинаміки, як і перший, не виведений теоретично, а носить статус постулату. Однак його достовірність підтверджують слідства з нього відповідні експериментальним спостереженням. У фізичній хімії частіше зустрічається наступна формулювання: “У будь-якої ізольованої системи, яка не перебуває у стані рівноваги, ентропія зростає з плином часу, причому триває її зростання, поки система не увійде в стан рівноваги”.
Математично цей постулат хімічної термодинаміки має вигляд: dSизол≥0. Знак нерівності в даному випадку вказує на неравновесность стану, а знак “=” на рівновагу.