Є таке з’єднання: винна кислота. Вона є відходом виноробної промисловості. Спочатку винна кислота міститься у виноградному соку у вигляді своєї кислої натрієвої солі. Проте в процесі бродіння цукор під дією спеціальних дріжджів перетворюється в спирт, і від цього розчинність солі винної кислоти падає. Тоді вона випадає в осад, який називають винним каменем. Її кристалізують, підкислюють і, врешті-решт, отримують саму кислоту. Однак з нею не все так просто.
Пастер
Насправді в розчині містяться дві кислоти: винну і інша, виноградна. Вони розрізняються тим, що винна кислота має оптичною активністю (обертає площину поляризованого світла праворуч), а виноградна – ні. Луї Пастер досліджував це явище і встановив, що кристали, що утворюються в кожній з кислот, є дзеркальним відображенням один одного, тобто припустив зв’язок між формою кристалів і оптичною активністю речовин. У 1848 році він після серії експериментів заявив про новий вид ізомерії винних кислот, який назвав энантиомерией.
Вант-Гофф
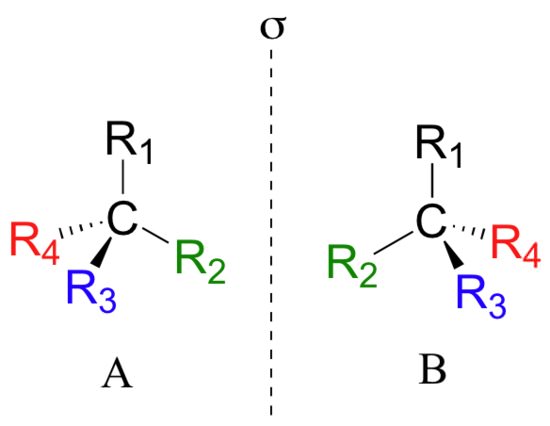
Якоб Вант-Гофф ввів поняття так званого асиметричного (або хіральним) атома вуглецю. Це такий вуглець, який в органічній молекулі зв’язаний з чотирма різними атомами. Наприклад, у винної кислоти другий атом в ланцюжку має в сусідах карбоксильную групу, водень, кисень і другий шматок винної кислоти. Оскільки в такій конфігурації вуглець має свої зв’язки у формі тетраедра, можна отримати дві сполуки, які є дзеркальним відображенням один одного, але «накласти» їх одне на інше, не змінюючи порядку зв’язків в молекулі, буде неможливо. До речі, такий спосіб визначати хіральність – це пропозиція лорда Кельвіна: відображення групи точок (в нашому випадку точки – атоми в молекулі), що володіють хіральність, в ідеальному плоскому дзеркалі не може бути поєднане з самою групою точок.
Симетрія молекул
Пояснення з дзеркалом виглядає просто і красиво, але в сучасної органічної хімії, де досліджуються молекули справді величезні, цей умоглядний метод пов’язаний зі значними труднощами. Тому звертаються до математики. Точніше, до симетрії. Існують так звані елементи симетрії – вісь, площину. Ми крутимо-вертим молекулу, залишаючи елемент симетрії нерухомим, і молекула після повороту на певний кут (360°, 180° або ще як-небудь) починає виглядати точно так само, як і спочатку.
І той самий асиметричний атом вуглецю, введений Вант-Гоффом, є основа самого простого виду симетрії. Цей атом – хиральный центр молекули. Він тетраэдрический: має чотири зв’язку з різними заступниками на кожній. І тому, провертаючи з’єднання по осі, що містить такий атом, ми отримаємо ідентичну картинку тільки після повного повороту на 360°.
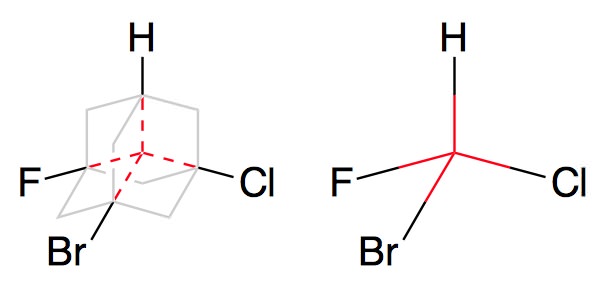
Взагалі, хіральні центром молекули може бути не тільки один атом. Наприклад, є таке цікаве поєднання – адамантан. Він схожий на тетраедр, у якого кожне ребро додатково шугнули назовні, і в кожному кутку – атом вуглецю. Тетраедр симетричний відносно свого центру, і молекула адамантану – теж. І якщо у чотири однакових «вузла» адамантану додати чотири різних заступника, то він теж знайде точкову симетрію. Адже якщо повертати його щодо свого внутрішнього «центру тяжіння», картинка співпаде з початкової тільки через 360°. Тут замість асиметричного атома роль хіральним центру грає «порожній» центр адамантану.
Стереоізомери в біоорганічних з’єднаннях
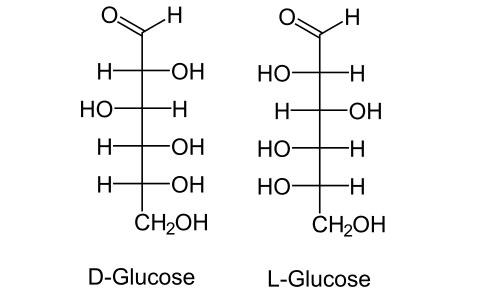
Хіральність – це вкрай важлива властивість для біологічно активних сполук. У процесах життєдіяльності беруть участь тільки ізомери з певним будовою. І практично всі значущі для організму речовини влаштовані так, що мають як мінімум один хиральный центр. Самий популярний приклад – цукру. Ось глюкоза. В її ланцюжку шість атомів вуглецю. З них чотири атоми мають біля себе чотири різних заступника. Значить, все для глюкози існує 16 можливих оптичних ізомерів. Всі вони поділяються на дві великі групи по конфігурації найближчого до спиртової групи асиметричного атома вуглецю: D-сахариди і L-сахариди. В обмінних процесах в живому організмі беруть участь тільки D-сахариди.
Також досить поширений для стереоизомерии у біоорганічної хімії приклад – амінокислоти. Всі природні амінокислоти мають аміногрупи біля найближчого до карбоксильної групи атома вуглецю. Таким чином, в будь-амінокислоти цей атом буде асиметричним (різні заступники – карбоксильна група, аміногрупа, водень і інша частина ланцюжка; виняток – гліцин з двома атомами водню).
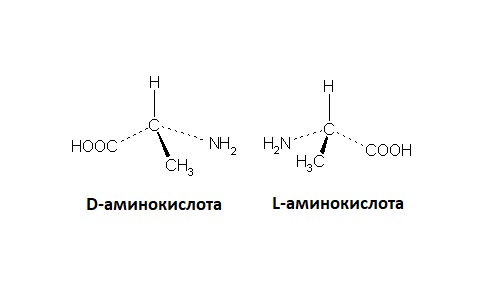
Відповідно, по конфігурації цього атома всі амінокислоти також ділять на D-ряд і L-ряд, тільки в природних процесах, на відміну від цукрів, переважає L-ряд.