Методи знаходження молекулярної маси білка бувають хімічними, фізико-хімічними і фізичними. Найпоширенішими фізико-хімічними методами є гель-хроматографія (як колоночная, так і тонкошарова) та електрофорез в середовищі поліакриламідного гелю в присутності додецилсульфату натрію. Вони не вимагають складного обладнання та великих кількостей досліджуваного матеріалу.
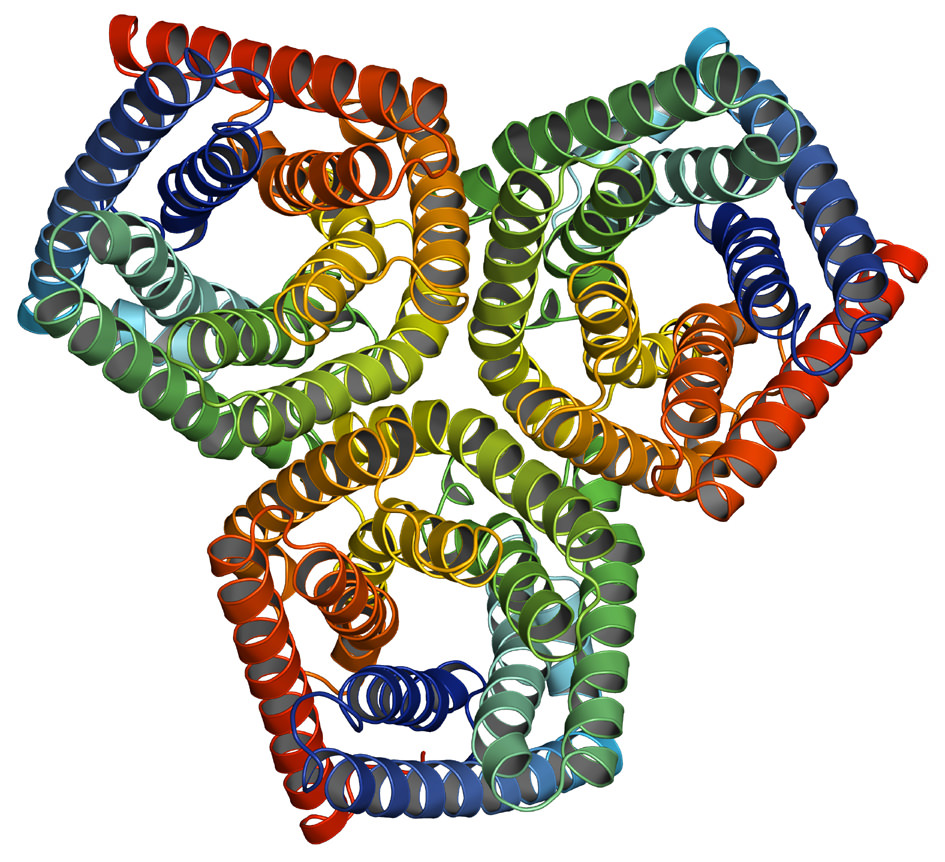
Характеристика білків
Білки являють собою високомолекулярні полімери біологічного походження. Вони складаються з амінокислот, сполучених послідовно пептидними зв’язками. Розміри білків залежать від кількості цих самих амінокислот. Середні значення елементного складу білків в %:
- вуглецю – в інтервалі 50,6-54,5;
- кисню – в межах 21,5-23,5;
- азоту – близько 15,0-17,6;
- водню –в інтервалі 6,5-7,3;
- сірки – в межах 0,3-2,5;
- мінеральних речовин – не більше 0,5.
Білки поділяють на прості, що складаються тільки із залишків амінокислот, і складні, що включають простетические групи. Небелковые компоненти можуть бути вуглеводами, ліпідами, нуклеїновими кислотами, похідними вітамінів, іонами металів, гемом і ін Розрізняють чотири структури білків.
Амінокислотний склад білків знаходять шляхом кислотного гідролізу, поєднаної із наступним поділом звільнилися амінокислот за допомогою іонообмінної хроматографії.
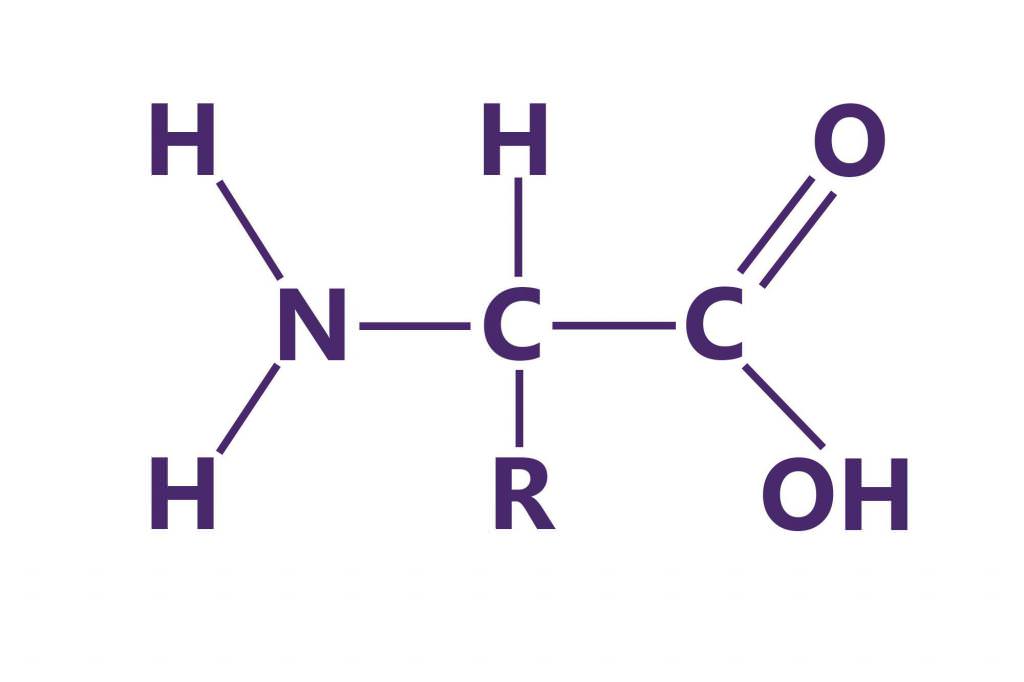
Кількісні показники кожної з амінокислот визначають нін-гидриновым методом. Виявлення розміщення амінокислот у молекулі білка здійснюють шляхом послідовного відщеплення кінцевих амінокислот з допомогою ферментів та їх ідентифікацією, що дозволяє визначити структуру білкової молекули. Ідентифікація заснована на їх різних фізико-хімічних властивостях. Нерідко для цього використовують кольорові реакції на ті або інші амінокислоти та хроматографію.
Колоночная гель-хроматографія
Цей метод базується на лінійній залежності логарифма молекулярної маси багатьох глобулярных білків і обсягу элюирования із заповненою гелем (визначеного розміру пор). Таким чином, для визначення молекулярної маси білка слід лише знайти обсяг його елюції з откалиброванной заздалегідь колонки. Калібрування виконують методом пропускання через колонку білків з заздалегідь відомими масами молекул і заміряючи обсяги елюції кожного з них. Якщо в якості заповнювача використовують сефадекс G-75, то розрахунок молекулярної маси ведуть по знайденому експериментальним шляхом рівнянню:
lg M = 5,624 – 0,752 · (Vэ / Vo),
де М – шукана молекулярна маса; Vэ – виходить з колонки об’єм розчину з досліджуваним речовиною; Vo – обсяг вільної колонки.
Для проведення аналізу знадобляться розчин блакитного декстрану (1%), розчин NaCl (0,1 моль/л), сефадекс G-75 (4 г), розчин гемоглобіну (1%).

Виконання аналізу
Підготовлену колонку заповнюють гелем сефадекса G-75 та промивають розчином NaCl. Після того як зіллють розчин NaCl, піднімається вище рівня гелю, на його поверхню акуратно поміщають 0,5 мл розчину блакитного декстрану. Потім збирають виходять з колонки рідини в мірний циліндр, де їх зберігають до кінця експерименту. Початківець витікати розчин з блакитний забарвленням збирають по 20 крапель у підготовлені заздалегідь пробірки. Елюатів з них від першого до самого інтенсивно забарвленого зливають в той же мірний циліндр, в якому вже зібрані незабарвлені фракції. Об’єм пробірок ослаблої забарвленням розчину не враховують.
Об’єм рідини, зібраної в мірний циліндр, складається вільним об’ємом колонки (Vo). Далі повторюють заповнення колонки, але замість блакитного декстрину використовують розчин гемоглобіну. Об’єм елюату в мірному циліндрі до виходу розчину з максимально рожевим забарвленням є величиною Vэ. Знайдені значення Vo і Vэ підставляють у відповідне рівняння і обчислюють масу білка. Амінокислотний склад білків знаходять подібними методиками.

Тонкошарова гель-хроматографія
Принцип цього методу полягає в тому, що в ході просування розчину білків по пластині з найтоншим шаром сефадекса, їх суміш розподіляється нерівномірно. По відстані, пройденого кожним з білків від початкової стартової лінії, знаходять логарифми їх молекулярних мас. Для визначення молекулярної маси білка методом тонкошарової гель-хроматографії будують калібрувальний графік, що відображає залежність пройдених маркерними білками відстаней від логарифмів їх молекулярних мас. Вже по ньому знаходять довжину шляху досліджуваного білка і масу його молекули.
Для виконання експерименту потрібно столик із змінним кутом нахилу, а також хроматографічну камеру. З реактивів знадобляться сефадекс G-200 або G-150, натрій-фосфатний буфер, рн 7,4 (0,1 моль/л), розчин бромфенолового синього (0,1%), розчин СН3СООН (5%), розчин CH3COONa (2 %), набір маркерних білків, хроматографічний папір.
Виконання експерименту
Спочатку необхідно приготувати гель сефадекса, для чого суху його масу 4 м суспендують в надмірній кількості натрій-фосфатного буфера, а потім залишають для набухання протягом 3 діб при н. у. Скляну пластинку зі сторонами 20х40 см ретельно промивають. Перед нанесенням на неї сефадекса буфер над ним декантуют, а потім гель добре перемішують. На горизонтально розташовану пластину його наносять порцелянової ложечкою, а потім розподіляють прокатуванням скляної палички розміром 1х22 див. Прокатування повторюють до рівномірного розподілу шару гелю без грудок і бульбашок товщиною 1 мм Підготовлену пластинку просушують на повітрі 15 хв., а потім поміщають в хроматографічну камеру.

В крайні ємності заливають фосфатний буфер, гель з’єднують з буфером хроматографічної папером. Далі камеру закривають і поміщають на спеціальну підставку. Кут її нахилу встановлюють на 7-10°. Для насичення камеру залишають на ніч.
Розчини білків, молекулярна маса яких відома, так само, як і досліджувані зразки, наносять микропипеткой, обсяг кожної порції повинен бути по 0,02 мл Пластинку повертають у горизонтальне положення і наносять порції білка в певні точки. Відстань між ними і від верхнього краю повинно бути 3 див. Потім камеру закривають і ставлять під кутом 7-10°. Гель-хроматографічний аналіз проводять 4 ч.
Після закінчення відведеного часу камеру ставлять горизонтально, хроматографічну папір видаляють. Скляну пластинку поміщають на підставку в горизонтальному положенні і знімають “репліку” на папір для хроматографії. Для цього її згортають в трубочку і накладають на тонкий гелевий шар, поступово розгортаючи. При цьому папір має пристати до нього, але робити це потрібно акуратно, щоб зберегти його в цілості. Папір залишають на поверхні пластинки 1 хв., після цього висушують при температурі 90 °С 20 хв. і поміщають в спеціальну кювету для фарбування.
Розшифровка результатів
Щоб ідентифікувати білкові зони, “репліку” поміщають в розчин бромфенолового синього на 3 хвилини. Далі барвник потрібно відмити двічі розчином оцтової кислоти і закріпити ацетатом натрію. Після цього хроматографічну папір ретельно промивають в холодній проточній воді і висушують. Далі приступають до вимірювання відстані, пройденого кожним білком від вихідної точки до центру плями.
За отриманими даними будують калібрувальний графік, шляхом відкладання по осі абсцис lа/lст (де індекс а відноситься до анализируемому, а ст – до стандартного білку), по осі ординат – lgM. Вимірявши відстань білкової області досліджуваного зразка від старту, за побудованим графіком визначають молекулярну масу і передбачувану структуру білкової молекули.