Світ, в якому ми з вами живемо, неймовірно прекрасний і сповнений безлічі різних процесів, які задають протягом життя. Всі ці процеси вивчає всім знайома наука – фізика. Вона дає можливість отримати хоч якесь уявлення про походження Всесвіту. У даній статті ми розглянемо таке поняття, як молекулярно-кінетична теорія, її рівняння, види та формули. Однак, перш ніж перейти до більш глибокого вивчення цих питань, потрібно прояснити для себе сам сенс фізики і областей, що нею вивчаються.
Що ж таке фізика?

Насправді, це дуже велика наука і, мабуть, одна з найбільш фундаментальних за всю історію людства. Наприклад, якщо та ж інформатика пов’язана практично з кожною областю людської діяльності, будь то розрахункове проектування чи створення мультфільмів, то фізика – це саме життя, опис її складних процесів і течій. Давайте постараємося розібрати її сенс, максимально спростивши розуміння.
Таким чином, фізика – це наука, яка займається вивченням енергії і матерії, зв’язків між ними, поясненням багатьох процесів, що відбуваються в нашої неосяжної Всесвіту. Молекулярно-кінетична теорія будови речовини – лише мала крапля в морі теорій і розділів фізики.
Енергію, яку докладно вивчає дана наука, можна представити у різних формах. Наприклад, у вигляді світла, руху, гравітації, випромінювання, електрики і в багатьох інших видах. Нами буде порушена в даній статті молекулярна кінетична теорія будови цих форм.
Вивчення матерії дає нам уявлення про атомарному будову речовини. Воно, до речі, випливає з молекулярно-кінетичної теорії. Наука про будову матерії дозволяє зрозуміти і знайти сенс нашого існування, причини виникнення життя і Всесвіту. Давайте все-таки постараємося вивчити молекулярно-кінетичну теорію речовини.
Для початку необхідно деякий вступ для повного усвідомлення термінології і яких-небудь висновків.
Розділи фізики
Відповідаючи на питання про те, що таке молекулярно-кінетична теорія, не можна не поговорити про розділах фізики. Кожен з цих них займається детальним вивченням і поясненням певної галузі людського життя. Вони класифікуються наступним чином:
- Механіка, яка поділяється ще на два розділу: кінематика і динаміка.
- Статика.
- Термодинаміка.
- Молекулярний розділ.
- Електродинаміка.
- Оптика.
- Фізика квантів і атомного ядра.
Поговоримо конкретно про молекулярної фізики, адже саме в її основі лежить молекулярно-кінетична теорія.
Що таке термодинаміка?
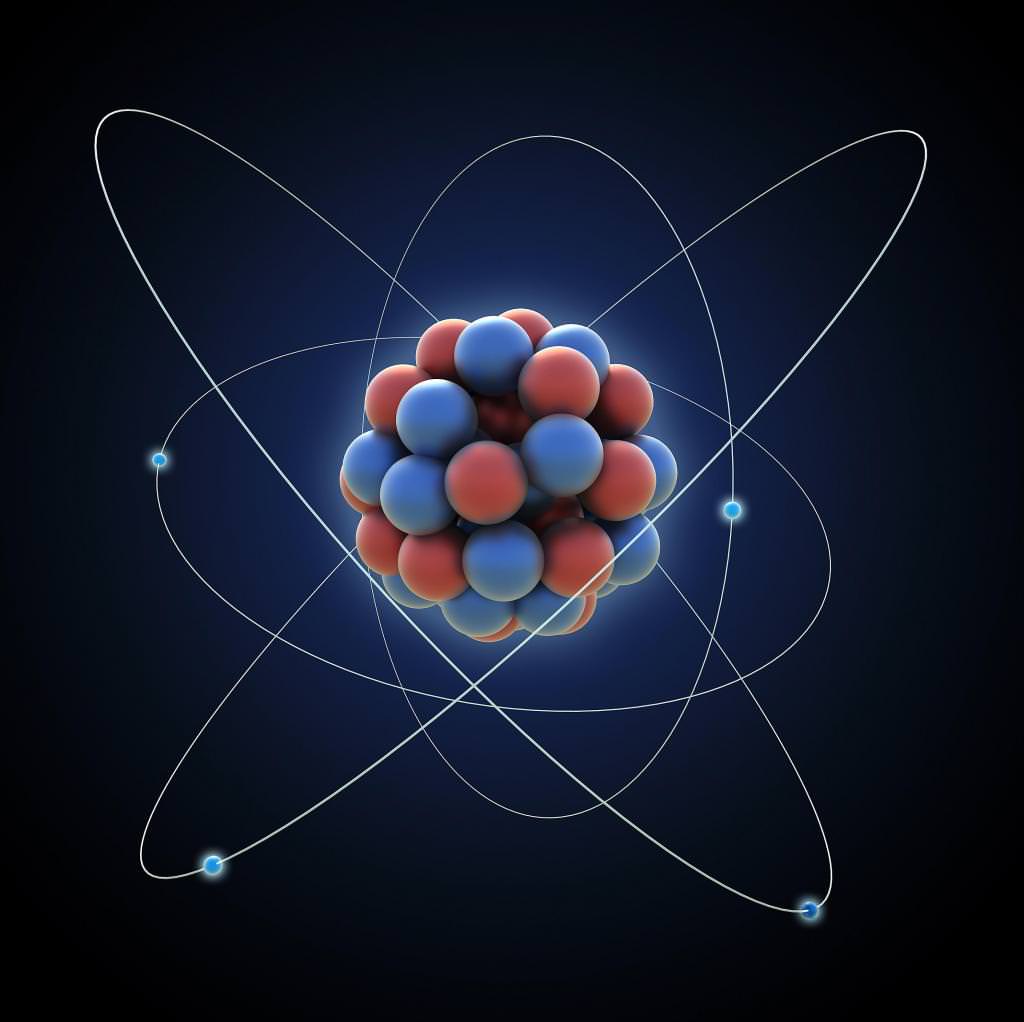
Взагалі, молекулярна частина і термодинаміка є тісно пов’язаними розділами фізики, які займаються вивченням виключно макроскопічної складовою загального числа фізичних систем. Варто пам’ятати, що ці науки описують саме внутрішній стан тіл і речовин. Наприклад, їх стан при нагріванні, кристалізації, паротворенні і конденсації, на атомарному рівні. Іншими словами, молекулярна фізика – наука про системи, які складаються з величезної кількості частинок: атомів і молекул.
Саме цими науками були вивчені основні положення молекулярно-кінетичної теорії.
Ще в курсі сьомого класу ми познайомилися з поняттями мікро – і макромиров, систем. Не буде зайвим освіжити ці терміни в пам’яті.
Мікросвіт, як ми можемо помітити з самої його назви, становлять елементарні частинки. Іншими словами, це світ малих частинок. Розміри їх вимірюються в межах від 10-18 м до 10-4 м, а час їх фактичного стану може досягти як нескінченності, так і неспівмірно малих проміжків, наприклад, 10-20 с.
Макросвіт розглядає тіла і системи стійких форм, що складаються з безлічі елементарних частинок. Такі системи порівнянні з нашими, людськими розмірами.
Крім того, існує і таке поняття, як мегасвіт. Його складають величезних масштабів планети, космічні галактики і комплекси.
Основні положення теорії
Тепер, коли ми трохи повторили і згадали основні терміни фізики, можемо перейти безпосередньо до розгляду головної теми даної статті.
Молекулярно-кінетична теорія з’явилася і була вперше сформульована ще в дев’ятнадцятому столітті. Суть її полягає в тому, що вона докладно описує будову якого-небудь речовини (частіше будова газів, ніж твердих і рідких тіл), грунтуючись на трьох фундаментальних положеннях, які були зібрані з припущень таких видатних науковців, як Роберт Гук, Ісаак Ньютон, Данило Бернуллі, Михайло Ломоносов та багатьох інших.
Основні положення молекулярно-кінетичної теорії звучать так:
Варто відзначити, що іншим прикладом, що описує положення під номером два, яке може належати також, наприклад, до молекулярно кінетичної теорії газів, служить дифузія. З нею ми зустрічаємося в повсякденному житті, і в багаторазових тестах і контрольних, тому важливо мати про неї уявлення.
Для початку розглянемо наступні приклади:
Лікар випадково пролив на стіл спирт з колби. Або ж ви впустили флакон з духами, а вони розтеклися по підлозі.
Чому в цих двох випадках і запах спирту, і запах парфумів через якийсь час наповнить всю кімнату, а не тільки ту сферу, куди пролилося вміст цих речовин?
Відповідь проста: дифузія.
Дифузія – що це? Як вона протікає?

Це процес, при якому частинки, що входять до складу якогось одного певного речовини (частіше газу), проникають у міжмолекулярні порожнечі іншого. У наших прикладах, наведених вище, сталося наступне: за рахунок теплового, тобто безперервного і роз’єднаного руху, молекули спирту та/або духів потрапляли у проміжки між молекулами повітря. Поступово, під дією зіткнення з атомами і молекулами повітря, вони поширювалися по кімнаті. До речі, інтенсивність дифузії, тобто швидкість її протікання, залежить від щільності речовин, що беруть участь у дифузії, а також від енергії руху їх атомів і молекул, називається кінетичною. Чим більше кінетична енергія, тим вище швидкість цих молекул, відповідно, і інтенсивність.
Найбільш швидким процесом дифузії можна назвати дифузії в газах. Це пов’язано з тим, що газ не є однорідним за своїм складом, а це означає, що міжмолекулярні порожнечі в газах займають значний обсяг простору, відповідно, і процес потрапляння атомів і молекул стороннього речовини в них протікає простіше і швидше.
Трохи повільніше цей процес проходить в рідинах. Розчинення кубиків цукру в чашці з чаєм – якраз приклад дифузії твердого тіла в рідині.
Але найтривалішою за часом є дифузія в тілах з твердою кристалічною структурою. Це саме так, тому що структура твердих тіл однорідна і має міцну кристалічну решітку, в комірках якої атоми твердого речовини коливаються. Наприклад, якщо поверхні двох металевих брусків добре очистити, а потім змусити їх контактувати один з одним, то через досить тривалий час ми зможемо виявити шматочки одного металу в іншому, і навпаки.
Як і будь-який інший фундаментальний розділ, основна теорія фізики підрозділяється на окремі частини: класифікацію, види, формули, рівняння і так далі. Таким чином, ми вивчили основи молекулярно-кінетичної теорії. Це означає, що можна спокійно перейти до розгляду окремих теоретичних блоків.
Молекулярно-кінетична теорія газів
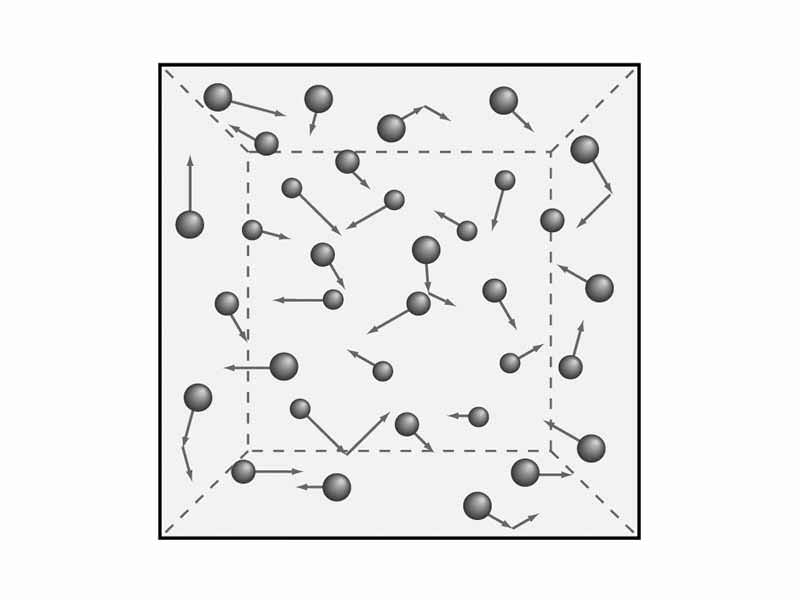
З’являється необхідність в розумінні положень газової теорії. Як ми говорили раніше, нами будуть розглянуті макроскопічні характеристики газів, наприклад, тиск і температура. Це знадобиться надалі для того, щоб вивести рівняння молекулярно-кінетичної теорії газів. Але математика – потім, а зараз займемося теорією і, відповідно, фізикою.
Вченими були сформульовані п’ять положень молекулярної теорії газів, які служать для осмислення кінетичної моделі газів. Вони звучать так:
П’яте положення ми з вами можемо переписати через такий вигляд рівняння молекулярно-кінетичної теорії газів:
Е=1/2*m*v^2=3/2*k*T,
де k – це постійна Больцмана; Т – температура в Кельвінах.
Це рівняння дає нам зрозуміти зв’язок між швидкістю елементарних частинок газу і їх абсолютною температурою. Відповідно, чим вище їх абсолютна температура, тим більше швидкість і кінетична енергія.
Тиск газів
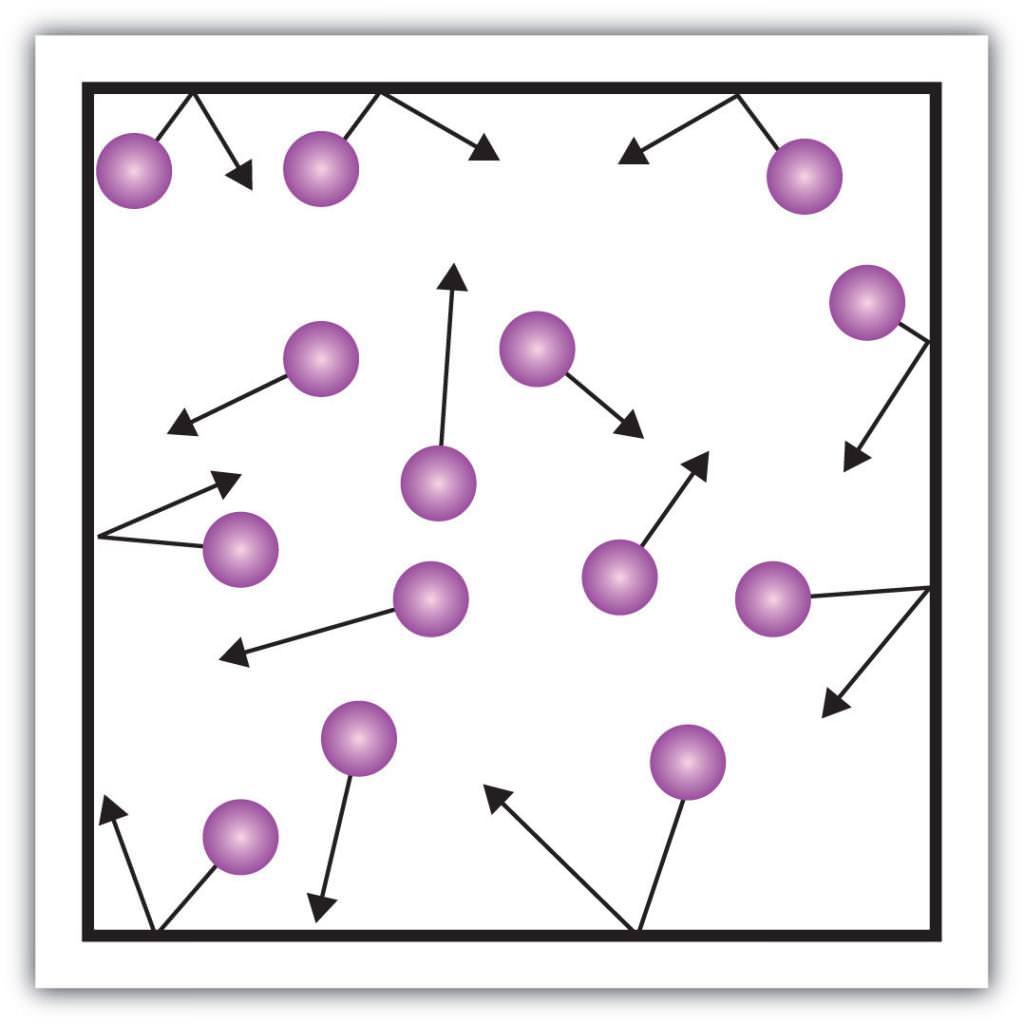
Такі макроскопічні складові характеристики, як, наприклад, тиск газів, що також можна пояснити з допомогою кінетичної теорії. Для цього наведемо такий приклад.
Припустимо, що молекула якогось газу знаходиться в ящику, довжина якого L. Скористаємося вищевикладеними положеннями газової теорії і врахуємо той факт, що молекулярна сфера рухається тільки по іксовій осі. Таким чином, ми зможемо спостерігати процес пружного зіткнення з однієї з стінок судини (ящика).
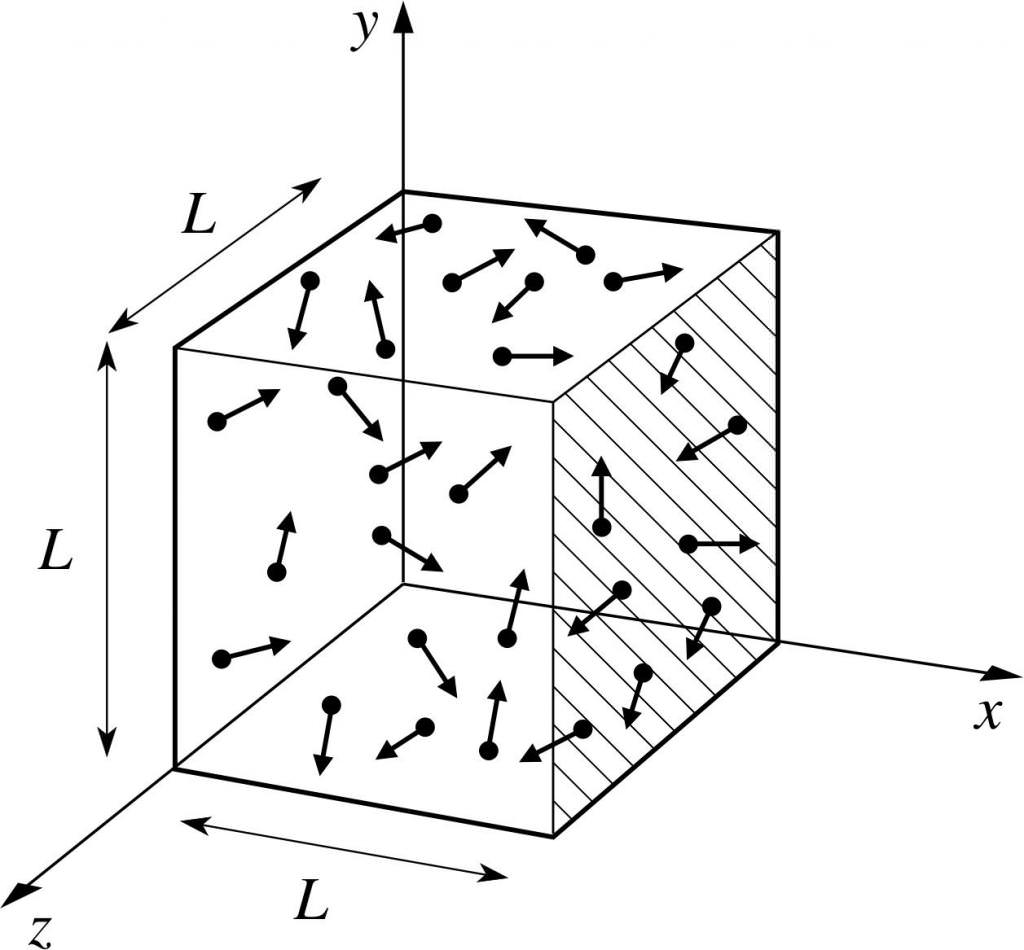
Імпульс відбувається зіткнення, як нам відомо, визначається формулою: p=m*v, але в даному випадку ця формула набуде проекційний вигляд: p=m*v(х).
Оскільки нами розглядається тільки розмірність осі абсцис, тобто осі х, то загальна зміна імпульсу буде виражена формулою: m*v(х) – m*(-v(х))=2*m*v(х).
Далі розглянемо силу, що надається нашим об’єктом за допомогою другого закону Ньютона: F=m*a=P/t.
З цих формул виразимо тиск з боку газу: P=F/a;
Тепер підставимо в отриману формулу вираження сили і отримаємо: P=m*v(х)^2/L^3.
Після цього нашу готову формулу тиску можна записати для N-го числа молекул газу. Іншими словами, вона матиме наступний вигляд:
P=N*m*v(х)^2/V, де v – швидкість, а V – об’єм.
Тепер спробуємо виділити кілька основних положень по тиску газу:
- Воно проявляється завдяки зіткнень молекул з молекулами стінок об’єкта, в якому він знаходиться.
- Величина тиску прямо пропорційна силі і швидкості наголоси молекул об стінки посудини.
Трохи коротких висновків з теорії
Перш ніж піти далі і розглянути основне рівняння молекулярно-кінетичної теорії, ми пропонуємо вам кілька коротких висновків з вищеописаних пунктів і теорії:
- Мірою середньої енергії руху її атомів і молекул є абсолютна температура.
- У тому випадку, коли два різних газу знаходяться при тотожною температурі, їх молекули мають однакову середню кінетичну енергію.
- Енергія газових частинок прямо пропорційна середньоквадратичної швидкості: Е=1/2*m*v^2.
- Хоча молекули газу і мають середню кінетичну енергію, відповідно, і середню швидкість, окремі частинки рухаються з різною швидкістю: будь-то швидко, то повільно.
- Чим вище температура, тим вище і швидкість молекул.
- У скільки разів ми збільшуємо температуру газу (наприклад, подвоюємо), у стільки разів збільшується і енергія руху його частинок (відповідно, подвоюється).
Основне рівняння і формули

Основне рівняння молекулярно-кінетичної теорії дозволяє встановити взаємозв’язок між величинами мікросвіту і, відповідно, макроскопічними, тобто вимірюваними, величинами.
Однією з найпростіших моделей, які може розглядати молекулярна теорія, вважається модель ідеального газу.
Можна сказати, що це своєрідна уявна модель, що вивчається молекулярно-кінетичної теорії ідеального газу, в якій:
- найпростіші частинки газу розглядаються в якості ідеально пружних куль, які проявляють взаємодія як один з одним, так і з молекулами стінок якого б то ні було посудини тільки в одному випадку – абсолютно пружного зіткнення;
- сили тяжіння всередині газу відсутні, чи можна ними фактично знехтувати;
- елементи внутрішньої будови газу можуть прийматися в якості матеріальних точок, тобто їх обсягом можна також знехтувати.
Розглядаючи таку модель, фізик Рудольф Клаузіус німецького походження написав формулу тиску газу через зв’язок мікро – і макроскопічних параметрів. Вона має вигляд:
р=1/3*m(0)*n*v^2.
Пізніше цю формулу назвуть як основне рівняння молекулярно-кінетичної теорії ідеального газу. Її можна буде представити в декількох різних видах. Наше завдання зараз полягає в тому, щоб показати розділи, такі як молекулярна фізика, молекулярно-кінетична теорія, а значить і їх повні рівняння і види. Тому є змив в розгляді інших варіацій основної формули.
Нам відомо, що середню енергію, що характеризує рух молекул газу, можна знайти за допомогою формули: Е=m(0)*v^2/2.
У такому випадку ми можемо замінити вираз m(0)*v^2 у вихідній формулі тиску на середню кінетичну енергію. В результаті цього нам випаде можливість скласти основне рівняння молекулярно-кінетичної теорії газів в такій формі: р=2/3*n*E.
Крім того, ми з вами знаємо, що вираз m(0)*n можна розписати у вигляді добутку двох приватних:
m/N*N/V=m/V=ρ.
Після цих маніпуляцій ми можемо переписати нашу формулу рівняння молекулярно-кінетичної теорії ідеального газу вже в третьому, відмінному від інших, вигляді:
р=1/3*ρ*v^2.
Ну що, мабуть, це все, що потрібно знати з даної теми. Залишилося тільки систематизувати отримані знання у формі коротких (і не дуже) висновків.
Всі загальні висновки і формули з теми “Молекулярно-кінетична теорія”
Отже, приступимо.
По-перше:
Фізика – фундаментальна наука, що входить в курс природознавства, яка займається тим, що вивчає властивості матерії та енергії, їх будови, закономірностей неорганічної природи.
До її складу входять такі розділи:
- механіка (кінематика і динаміка);
- статика;
- термодинаміка;
- електродинаміка;
- молекулярний розділ;
- оптика;
- фізика квантів і атомного ядра.
По-друге:
Фізика простих частинок і термодинаміка є тісно пов’язаними розділами, які займаються вивченням виключно макроскопічної складовою загального числа фізичних систем, тобто систем, що складаються з величезного числа елементарних частинок.
В їх основі лежить молекулярно-кінетична теорія.
По-третє:
Суть питання полягає в наступному. Молекулярно-кінетична теорія докладно описує будову якого-небудь речовини (частіше будова газів, ніж твердих і рідких тіл), грунтуючись на трьох фундаментальних положеннях, які були зібрані з припущень відомих наукових діячів. Серед них: Роберт Гук, Ісаак Ньютон, Данило Бернуллі, Михайло Ломоносов та багато інших.
В-четверте:
Три основних положення молекулярно-кінетичної теорії:
Кожне це положення молекулярно-кінетичної теорії є міцним фундаментом у вивченні будови матерії.
По-п’яте:
Кілька головних положень молекулярної теорії для моделі газу:
- Всі гази складаються з елементарних частинок, які не мають якогось певного розміру, але мають певну масу. Іншими словами, обсяг цих частинок мінімальний у порівнянні з відстанями між ними.
- Атоми і молекули газів практично не мають потенційної енергії, відповідно, їх повна енергія дорівнює кінетичної.
- З цим положенням ми вже знайомилися раніше – броунівський рух. Тобто, газові частинки завжди знаходяться в безперервному і безладному русі.
- Абсолютно всі взаємні зіткнення атомів і молекул газів, що супроводжуються повідомленням швидкості та енергії, є повністю еластичними. Це означає, що втрати енергії чи різкі скачки їх кінетичної енергії при зіткненні відсутні.
- При нормальних умовах і постійній температурі середня кінетична енергія практично всіх газів однакова.
По-шосте:
Висновки з теорії газів:
- Абсолютна температура є мірою середньої кінетичної енергії її атомів і молекул.
- У тому випадку, коли два різних газу знаходяться при однаковій температурі, їх молекули мають однакову середню кінетичну енергію.
- Середня кінетична енергія частинок газу прямо пропорційна середньоквадратичної швидкості: Е=1/2*m*v^2.
- Хоча молекули газу і мають середню кінетичну енергію, відповідно, і середню швидкість, окремі частинки рухаються з різною швидкістю: будь-то швидко, то повільно.
- Чим вище температура, тим вище і швидкість молекул.
- У скільки разів ми збільшуємо температуру газу (наприклад, подвоюємо), у стільки разів збільшується і середня кінетична енергія його частинок (відповідно, подвоюється).
- Взаємозв’язок між тиском газу на стінки посудини, в якому він розташований, та інтенсивністю ударів молекул об ці стінки прямо пропорційна: чим більше ударів, тим вище тиск, і навпаки.
По-сьоме:
Модель ідеального газу – така модель, в якій повинні виконуватися наступні умови:
- Молекули газу можуть і розглядаються в якості ідеально пружних куль.
- Ці кулі можуть взаємодіяти один з одним і зі стінками якого б то ні було посудини тільки в одному випадку – абсолютно пружного зіткнення.
- Ті сили, які описують взаємну тягу між атомами і молекулами газу відсутні чи можна ними фактично знехтувати.
- Атоми і молекули розглядаються в якості матеріальних точок, тобто їх обсягом можна також знехтувати.
По-восьме:
Наведемо всі основні рівняння і покажемо в темі “Молекулярно-кінетична теорія” формули:
р=1/3*m(0)*n*v^2 – основне рівняння для моделі ідеального газу, виведена німецьким фізиком Рудольфом Клаузиусом.
р=2/3*n*E – основне рівняння молекулярно-кінетичної теорії ідеального газу. Виводиться через середню кінетичну енергію молекул.
р=1/3*ρ*v^2 – це ж рівняння, але розглянуте через щільність і середню квадратичну швидкість молекул ідеального газу.
m(0)=M/N(a) – формула для знаходження маси однієї молекули через число Авогадро.
v^2=(v(1)+v(2)+v(3)+…)/N – формула для знаходження середньої квадратичної швидкості молекул, де v(1),v(2),v(3) і так далі – швидкості першої молекули, другої, третьої і так далі до n-ної молекули.
n=N/V – формула для знаходження концентрації молекул, де N – кількість молекул в об’ємі газу до даного об’єму V.
Е=m*v^2/2=3/2*k*Т – формули для знаходження середньої кінетичної енергії молекул, де v^2 – середня квадратична швидкість молекул, k – постійна величина, названа на честь австрійського фізика Людвіга Больцмана, а Т – це температура газу.
p=nkT – формула тиску через концентрацію, постійну Больцмана і абсолютну температуру Т. З неї випливає інша фундаментальна формула, відкрита російським ученим Менделєєвим і французьким фізиком-інженером Клайпероном:
pV=m/M*R*T, де R=k*N(a) – універсальна постійна для газів.
Тепер покажемо константи для різних ізо-процесів: изобарного, ізохорний, ізотермічного і адиабатного.
р*V/Т=const – виконується в тому випадку, коли маса і склад газу є незмінними величинами.
р*V=const – якщо при цьому постійна температура.
V/T=const – якщо постійно тиск газу.
p/T=const – якщо обсяг постійний.
Мабуть, це і все, що треба було б знати по цій темі.
Сьогодні ми з вами поринули у таку наукову галузь, як теоретична фізика, її численні розділи і блоки. Більш детально нами була порушена така область фізики, як фундаментальна молекулярна фізика і термодинаміка, а саме молекулярно-кінетична теорія, яка, здавалося б, не представляє ніяких складнощів при первинному вивченні, але насправді має безліч підводних каменів. Вона розширює наше уявлення про моделі ідеального газу, яку ми також докладно вивчили. Крім того, варто зазначити, що ми познайомилися і з основними рівняннями молекулярної теорії в різних їх варіаціях, а також розглянули всі самі необхідні формули для знаходження тих чи інших невідомих величин по цій темі Це буде особливо корисно при підготовці до написання будь-яких тестів, екзаменаційних і контрольних робіт, або для розширення загального кругозору і знань з фізики.
Сподіваємося, що дана стаття була вам корисна, і ви витягли з неї тільки саму необхідну інформацію, зміцнивши свої знання в таких стовпах термодинаміки, як основні положення молекулярно-кінетичної теорії.