Алкани, або ж парафінові вуглеводні – це найпростіший з усіх класів органічних сполук. Основна їх характеристика – присутність в молекулі тільки одинарних, або насичених зв’язків, звідки береться інша назва – насичені вуглеводні. Крім всім відомих нафти і газу, алкани також містяться в багатьох рослинних і тваринних тканинах: наприклад, феромони мухи цеце – алкани, що містять в своїх ланцюжках 18, 39 і 40 атомів вуглецю; також алкани у великій кількості містяться у верхньому захисному шарі рослин (кутикулі).
Загальні відомості
Алкани відносяться до класу вуглеводнів. Це означає, що у формулі будь-якого з’єднання будуть присутні тільки вуглець (С) і водень (H). Відрізняє їх лише те, що всі зв’язки в молекулі одинарні. Валентність вуглецю – 4, отже, один атом у з’єднанні завжди буде пов’язаний з чотирма іншими атомами. Причому як мінімум одна зв’язок буде види вуглець-вуглець, а інші можуть бути як вуглець-вуглецеві, так і вуглець-водневі (валентність водню – 1, так що про водень-водневих зв’язках думати заборонено). Відповідно, атом вуглецю, що має тільки одну C-C зв’язок, буде називатися первинним, дві C-C зв’язку – вторинним, три – третинним і чотири, за аналогією, четвертинним.
Якщо записати молекулярні формули всіх алканів на малюнку, вийде:
- CH4,
- C2H6,
- C 3 h 8.
і так далі. Неважко скласти універсальну формулу, що описує будь-яке з’єднання цього класу:
- C n h 2n+2.
Це загальна формула парафінових вуглеводнів. Сукупність усіх можливих формул для них становить гомологічний ряд. Різниця між двома найближчими членами ряду становить (-CH2-).
Номенклатура алканів
Перший і найпростіший в ряду насичених вуглеводнів – метан CH4. Далі йде етан C2H6, має два атоми вуглецю, пропан c 3 h 8, бутан C4H10, а з п’ятого члена гомологічного ряду алкани називаються за кількістю атомів вуглецю в молекулі: пентан, гексан, гептан, октан, нонан, декан, ундекан, додекан, тридекан і так далі. Однак “разом” кілька вуглеців можна назвати, тільки якщо вони знаходяться в одній лінійної ланцюжку. А так буває не завжди.

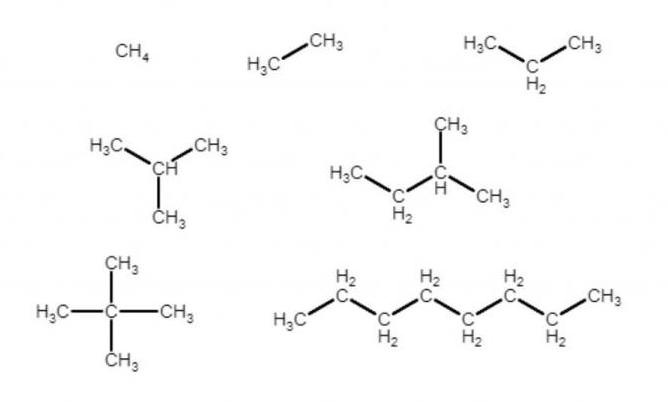
На даній картинці зображено кілька структур, молекулярні формули яких збігаються: C8H18. Однак перед нами – три різних з’єднання. Таке явище, коли для однієї молекулярної формули існує кілька різних структурних, називається ізомерією, а з’єднання – ізомерами. Тут спостерігається ізомерія вуглецевого скелета: це означає, що ізомери відрізняються порядком вуглець-вуглецевих зв’язків в молекулі.
Всі ізомери, що не володіють лінійною структурою, називаються розгалуженими. В їх номенклатурі беруть за основу найдовшу безперервну ланцюжок з атомів вуглецю в молекулі, а “відгалуження” вважаються заступниками одного з атомів водню при вуглеці з “основної” ланцюжка. Так виходять 2-метилпропан (ізобутан), 2,2-диметилпропан (неопентан), 2,2,4-триметилпентана. Цифра вказує на номер вуглецю основної ланцюжка, далі слідує кількість однакових заступників, далі назва заступника, далі ім’я основний ланцюжка.
Будова алканів
Всі чотири у зв’язку атома вуглецю – ковалентні сигма-зв’язку. Для утворення кожної з них вуглець використовує одну зі своїх чотирьох орбіталей на зовнішньому енергетичному рівні – 3s (одна штука), 3p (три штуки). Очікується, що раз у зв’язуванні беруть участь різні типи орбіталей, то й отримані зв’язку за своїми енергетичними характеристиками повинні бути різними. Однак такого не спостерігається – в молекулі метану всі чотири однакові.
Для пояснення цього явища використовується теорія гібридизації. Вона працює наступним чином: приймається, що ковалентний зв’язок – це як би два електрона (по одному від кожного атома у парі), що знаходяться рівно між зв’язаними атомами. У метані, наприклад, чотири таких зв’язку, тому чотири пари електронів в молекулі будуть відштовхуватись один від одного. Щоб мінімізувати це постійне штовхання, центральний атом у метані має в своєму розпорядженні всі чотири своїх зв’язки таким чином, щоб вони були якомога далі один від одного. При цьому, для ще більшої вигоди, він як би змішує всі свої орбіталі (3s – 3p – три), роблячи з них потім чотири нові однакові sp3-гібридні орбіталі. У підсумку “кінці” ковалентних зв’язків, на яких розташовані атоми водню, утворюють правильний тетраедр, в середині якого знаходиться вуглець. Такий фінт вухами називається sp3-гібридизацією.
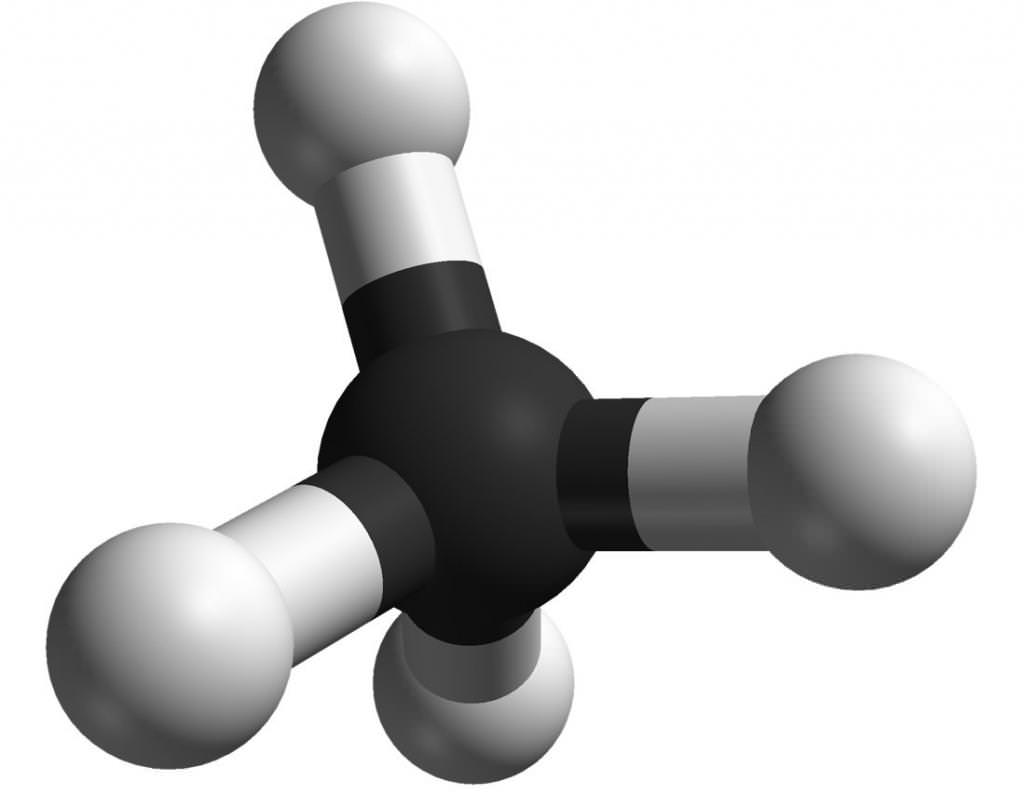
Всі атоми вуглецю в алканах знаходяться в sp3-гібридизації.
Фізичні властивості
Алкани з кількістю атомів вуглецю від 1 до 4 – гази, від 5 до 17 – рідини з різким запахом, схожим на запах бензину, вище 17 – тверді речовини. Температури кипіння і плавлення у алканів зростають разом з тим, як зростає їх молярна маса (і, відповідно, кількість атомів вуглецю в молекулі). Варто сказати, що за однакової молярної маси розгалужені алкани мають помітно більш низькі температури плавлення і кипіння, ніж їх нерозгалужені ізомери. Це означає, що міжмолекулярні зв’язки у них слабкіше, тому загальна структура речовини менш стійка до зовнішніх впливів (і при нагріванні ці зв’язки швидше руйнуються).
Незважаючи на такі відмінності, в середньому всі алкани вкрай неполярних: у воді вони практично не розчиняються (а вода – полярний розчинник). Зате самі ненасичені вуглеводні з тих, що в нормальних умовах є рідинами, активно використовуються в якості неполярних розчинників. Так використовують н-гексан, н-гептан, н-октан та інші.
Хімічні властивості
Алкани малоактивні: навіть порівняно з іншими органічними речовинами вони реагують з вкрай обмеженим списком реактивів. В основному це реакції, що протікають за радикальним механізмом: хлорування, бромирование, нітрування, сульфування та інше. Хлорування метану – класичний приклад ланцюгових реакцій. Суть його полягає в наступному.
Ланцюгова хімічна реакція складається з декількох стадій.
- спочатку відбувається зародження ланцюга – з’являються перші вільні радикали (в даному випадку це відбувається під дією фотонів);
- наступний етап – розвиток ланцюга. В ході нього утворюються нові речовини, які є результатом взаємодії якого-небудь вільного радикала і молекули; при цьому вивільняються нові вільні радикали, які, в свою чергу, реагують з іншими молекулами, і так далі;
- коли між стикаються і утворюють нове речовина два вільних радикала, відбувається обрив ланцюга – нових вільних радикалів не утворюється, і в цій гілці реакція згасає.
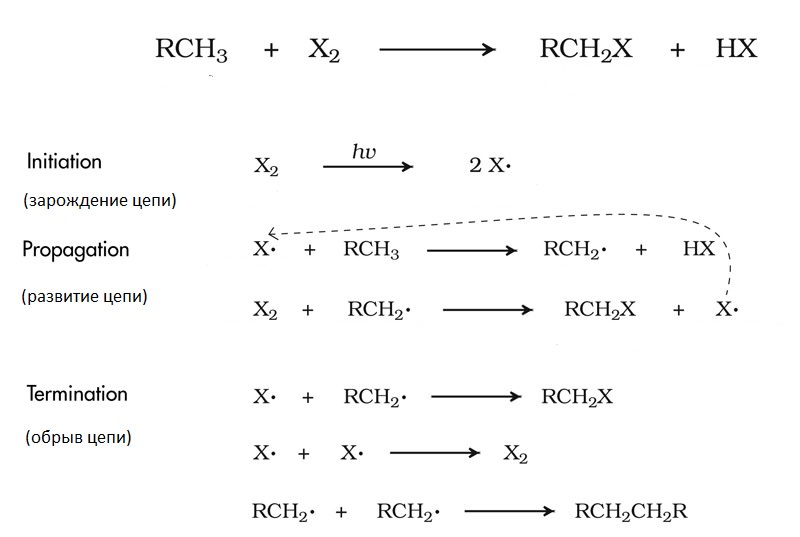
Проміжними продуктами реакції тут є і хлорметан CH3Cl, і дихлорметан CH2Cl2, і трихлорметан (хлороформ) CHCl3, і тетрахлорметан CCl4. Це означає, що радикали можуть атакувати кого завгодно: і власне метан, і проміжні продукти реакції, все більше і більше заміщаючи водень на галоген.
Вкрай важлива для промисловості реакція – це ізомеризація парафінових вуглеводнів. В ході її з нерозгалужених алканів отримують їх розгалужені ізомери. Це підвищує так звану детонаційну стійкість з’єднання – одну з характеристик автомобільного палива. Реакція проводиться на каталізаторі хлориду алюмінію AlCl3 при температурах близько 300оС.
Горіння алканів
Ще з початкової школи всі знають, що будь-яке органічне з’єднання згоряє з утворенням води і вуглекислого газу. Алкани не є винятком; проте в даному випадку набагато важливіше інше. Властивість парафінових вуглеводнів, особливо газоподібних – виділення при згорянні великої кількості тепла. Саме тому практично всі основні види палива виробляються з парафінів.

Корисні копалини на основі вуглеводнів
Це – останки древніх живих організмів, що пройшли довгий шлях хімічних змін без доступу кисню. Природний газ в середньому на 95% складається з метану. Іншу частину займають етан, пропан, бутан і незначні домішки.
З нафтою все набагато цікавіше. Вона являє собою цілий букет найрізноманітніших класів вуглеводнів. Але основну частину займають алкани, циклоалканы та ароматичні сполуки. Парафінові вуглеводні нафти поділяються на фракції (куди входять і ненасичені сусіди) за кількістю атомів вуглецю в молекулі:
- газолін (5-7 С);
- бензин (5-11);
- лігроїн (8-14);
- гас (12-18 С);
- газойль (16-25);
- масла – мазут, солярове, змащувальне та інші (20-70 С).

Згідно з фракцією, нафтова сировина йде на різні види палива. З цієї причини види палива (бензин, лігроїн – тракторне паливо, гас – реактивне, дизельне паливо) збігаються з фракційної класифікацією парафінових вуглеводнів.