У таблиці Менделєєва неметали розташовані у верхньому трикутнику, і при зменшенні номера групи їх кількість у ній також падає. У сьомій групі (галогени) всі елементи – неметали. Це фтор, хлор, бром, йод і астат. Хоча останній ми не розглядаємо, оскільки він, по-перше, сам по собі радіоактивний, в земній корі зустрічається тільки у вигляді проміжного продукту розпаду урану, а його з’єднання HAt (астатоводород), що отримується в лабораторії, вкрай нестійке і в розчині веде себе не так, як інші галогеноводороды. У шостій групі неметалів вже поменше (кисень, сірка, селен і телур, є металлоидом), у п’ятій їх три (азот, фосфор і миш’як), у четвертій – два (вуглець і кремній), а в третій сидить самотній бор. Водневі сполуки неметалів однієї групи мають схожі хімічні властивості.
Галогени
Галогеноводороды – це найбільш важливі сполуки галогенів. По своїм властивостям це безкисневі кислоти, у воді диссоциирующие на аніон галогену і катіон водню. Всі вони добре розчиняються. Хімічний зв’язок між атомами в молекулі ковалентний, електронна пара зміщена в бік галогену як більш електронегативного. Оскільки чим вище таблиці Менделєєва, тим більше электроотрицательность атома, зі зменшенням періоду ковалентний зв’язок стає все більш і більш полярною. Водень несе більший частковий позитивний заряд, в розчині легше відривається від галогену, тобто з’єднання дисоціює повніше і успішніше, і сила кислот зростає в ряду від йоду до хлору. Ми не сказали про фтор, тому що в його випадку спостерігається цілком протилежне: плавикова (фтороводородная кислота) – слабка і дуже погано дисоціюють у розчинах. Це пояснюється таким явищем, як водневі зв’язки: водень впроваджується в електронну оболонку атома фтору “чужий” молекули, і виникає межмолекулярная зв’язок, що не дозволяє з’єднанню дисоціювати як годиться.
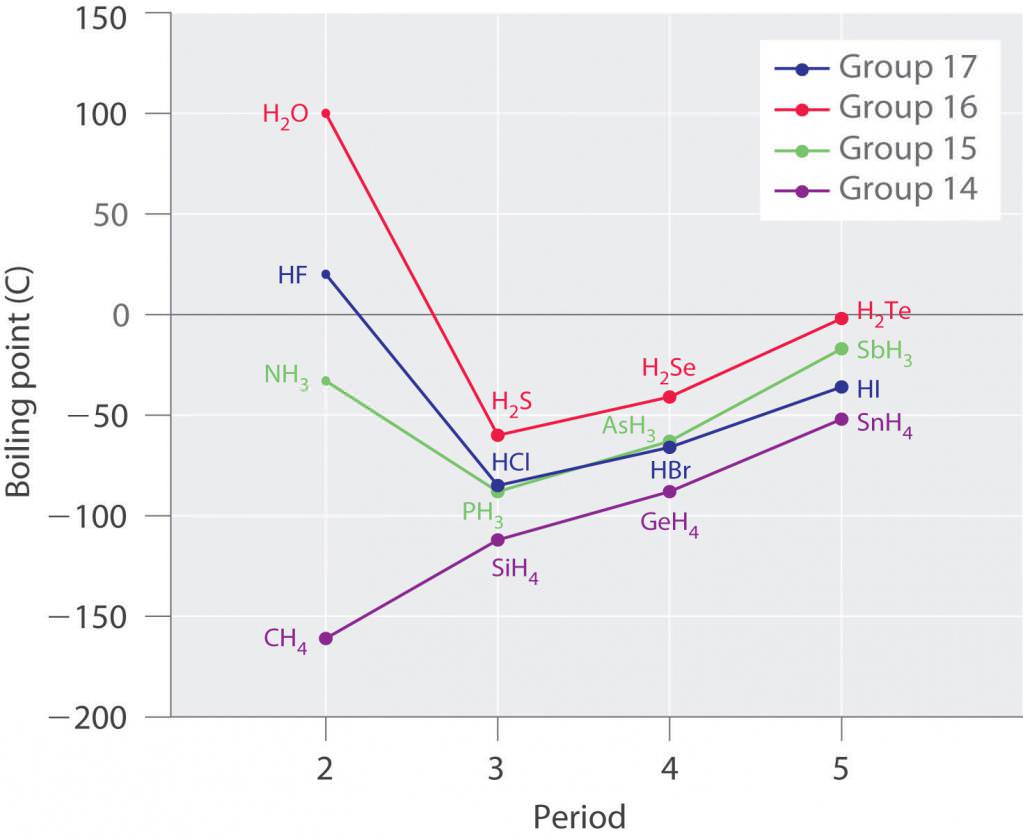
Це наочно підтверджується графіком з температурами кипіння різних водневих сполук неметалів: з них виділяються з’єднання елементів першого періоду – азоту, кисню і фтору – мають водневі зв’язки.
Група кисню
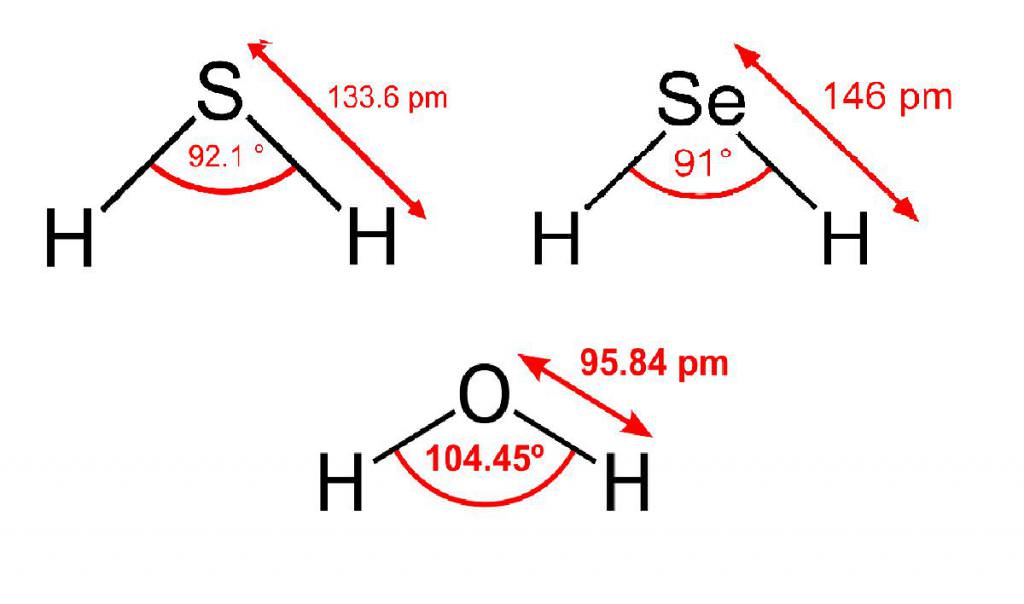
Водневе з’єднання кисню – це, очевидно, вода. Примітного про неї сказати нічого, крім того, що кисень в цьому з’єднанні, на відміну від сірки, селену і телуру в аналогічних, знаходиться в sp3-гібридизації – про це говорить валентний кут між двома зв’язками з воднем. Передбачається, що у решти елементів 6 групи такого не спостерігається із-за великої різниці в енергетичних характеристиках зовнішніх рівнів (у водню 1s, у кисню – 2s, 2p, в той час як у решти відповідно 3, 4 і 5).
Сірководень виділяється при гнитті білка, тому проявляється запахом тухлих яєць, отруйний. У природі зустрічається у вигляді вулканічного газу, що виділяється живими організмами при вже згаданих процесах (гниття). У хімії використовується в якості сильного відновника. При виверженні вулканів, змішуючись з сірчистим газом, утворює вулканічний сірку.
Селеноводород і теллуроводород – теж гази. Страшно отруйні і мають ще більш огидним запахом, ніж сірководень. По мірі збільшення періоду відновні властивості збільшуються, сила водних розчинів кислот – теж.
Група азоту
Аміак – одне з найвідоміших водневих сполук неметалів. Азот тут також знаходиться в sp3-гібридизації, зберігаючи при собі одну неподеленную електронну пару, за рахунок якої потім утворює різні іонні з’єднання. Володіє досить сильними відновними властивостями. Відомий хорошою здатністю (за рахунок тієї ж неподіленої електронної пари) до утворення комплексів, виступаючи в ролі ліганду. Відомі аміачні комплекси міді, цинку, заліза, кобальту, нікелю, срібла, золота і ще багато чого.
Фосфін – водневе з’єднання фосфору – має ще більш сильними відновними властивостями. Вкрай отруйний, самозаймається на повітрі. Має димер, присутній в суміші в малих кількостях.
Арсин – мышьяковистый водень. Токсичний, як і всі сполуки миш’яку. Має характерний часниковий запах, який з’являється за рахунок окислення частини речовини.
Вуглець і кремній
Метан – водневе з’єднання вуглецю – початкова точка на неозорому просторі органічної хімії. Так сталося саме з вуглецем, тому що він уміє утворювати довгі стійкі ланцюга зі зв’язками вуглець-вуглець. В рамках цієї статті варто сказати, що атом вуглецю також має тут sp3-гібридизацію. Основна реакція метану – це спалювання, в ході якого виділяється велика кількість тепла, з-за чого метан (природний газ) використовують в якості палива.
Силан – аналогічне з’єднання кремнію. Він самозаймається на повітрі і згоряє. Примітно те, що він також здатний до утворення ланцюжків, схожих на вуглецеві: відомі, наприклад, дисилан і трисилан. Проблема в тому, що кремній-кремнієва зв’язок набагато менш стійка, і ланцюжки легко руйнуються.
Бор
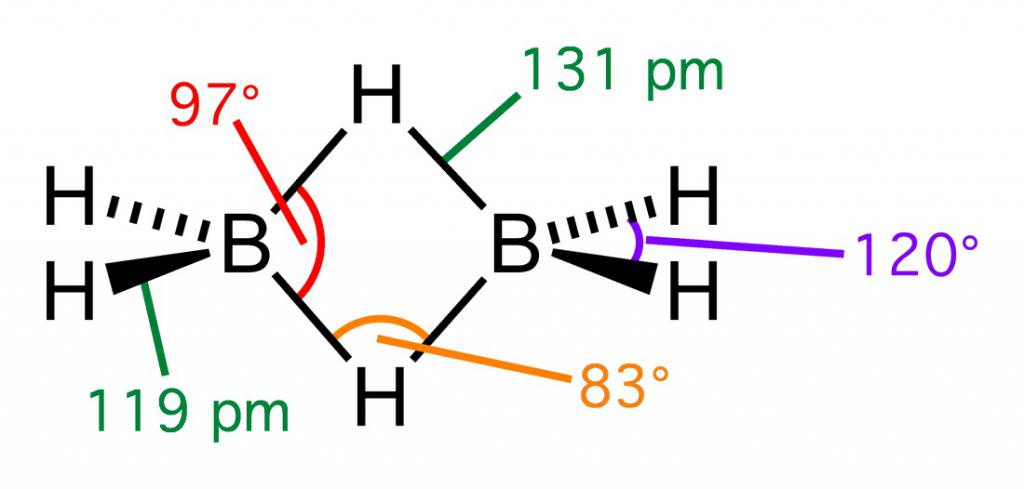
З бором все дуже цікаво. Справа в тому, що найпростіше його водневе з’єднання – боран – нестабільно і димеризуется, утворюючи диборан. Диборан самозаймається на повітрі, але сам по собі стабільний, як і деякі наступні борани, що містять в ланцюжку до 20 атомів бору – в цьому вони просунулися далі силанов з максимальним числом 8 атомів. Всі борани отруйні, в тому числі володіють властивостями нервово-паралітичних отруйних речовин.
Молекулярні формули водневих сполук неметалів і металів пишуться однаково, проте в будові вони різняться: у гідридів металів іонну будову, у неметалів – ковалентное.