У вивченні й практичному використанні атомних явищ одну з найважливіших ролей відіграють рентгенівські промені. Завдяки їх дослідженням було зроблено безліч відкриттів і розроблені методи аналізу речовини, що застосовуються в самих різних областях. Тут ми розглянемо один з видів рентгенівських променів – характеристичне рентгенівське випромінювання.
Природа і властивості рентгенівських променів
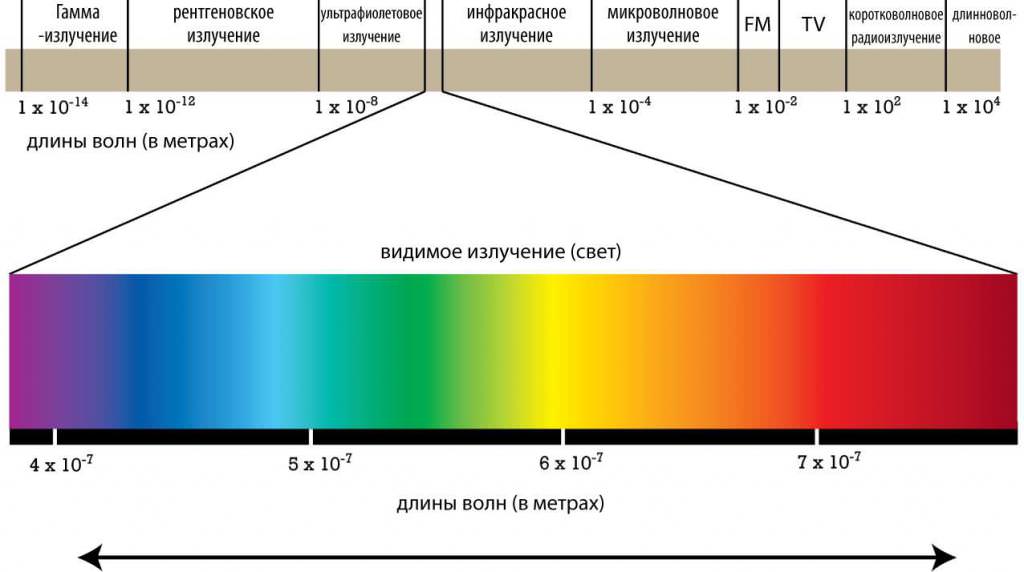
Рентгенівське випромінювання – це високочастотне зміна стану електромагнітного поля, яке поширюється в просторі зі швидкістю близько 300 000 км/с, тобто електромагнітні хвилі. На шкалі діапазону електромагнітного випромінювання рентген розташовується в області довжин хвиль приблизно від 10-8 до 5∙10-12 метрів, що на кілька порядків коротше оптичних хвиль. Це відповідає частотам від 3∙1016 до 6∙1019 Гц і енергіям від 10 ев до 250 кев, або 1,6∙10-18 до 4∙10-14 Дж. Слід зазначити, що межі частотних діапазонів електромагнітного випромінювання досить умовні внаслідок їх перекриття.
Джерелом рентгенівського випромінювання є взаємодія прискорених заряджених частинок (електронів високих енергій) з електричними і магнітними полями і з атомами речовини.
Фотонам рентгенівських променів властиві високі енергії і велика проникаюча та іонізуюча здатність, особливо для жорсткого рентгенівського з довжинами хвиль менше 1 нанометра (10-9 м).
Рентгенівські промені взаємодіють з речовиною, іонізуючи його атоми, в процесах фотоефекту (фотопоглощения) і некогерентного (комптоновского) розсіювання. При фотопоглощении рентгенівський фотон, поглинається електроном атома, передає йому енергію. Якщо її величина перевищує енергію зв’язку електрона в атомі, то він залишає атом. Комптоновское розсіяння характерно для більш жорстких (енергійних) рентгенівських фотонів. Частина енергії поглинутого фотона витрачається на іонізацію; при цьому під деяким кутом до напрямку первинного фотона, що випромінюється вторинний, з меншою частотою.