Алкани, або ж парафінові вуглеводні – це найпростіший з усіх класів органічних сполук. Основна їх характеристика – присутність в молекулі тільки одинарних, або насичених зв’язків, звідки береться інша назва – насичені вуглеводні. Крім всім відомих нафти і газу, алкани також містяться в багатьох рослинних і тваринних тканинах: наприклад, феромони мухи цеце – алкани, що містять в своїх ланцюжках 18, 39 і 40 атомів вуглецю; також алкани у великій кількості містяться у верхньому захисному шарі рослин (кутикулі).
Загальні відомості
Алкани відносяться до класу вуглеводнів. Це означає, що у формулі будь-якого з’єднання будуть присутні тільки вуглець (С) і водень (H). Відрізняє їх лише те, що всі зв’язки в молекулі одинарні. Валентність вуглецю – 4, отже, один атом у з’єднанні завжди буде пов’язаний з чотирма іншими атомами. Причому як мінімум одна зв’язок буде види вуглець-вуглець, а інші можуть бути як вуглець-вуглецеві, так і вуглець-водневі (валентність водню – 1, так що про водень-водневих зв’язках думати заборонено). Відповідно, атом вуглецю, що має тільки одну C-C зв’язок, буде називатися первинним, дві C-C зв’язку – вторинним, три – третинним і чотири, за аналогією, четвертинним.
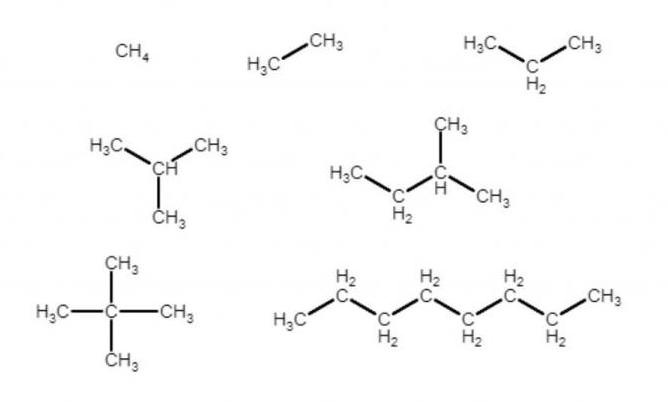
Якщо записати молекулярні формули всіх алканів на малюнку, вийде:
- CH4,
- C2H6,
- C 3 h 8.
і так далі. Неважко скласти універсальну формулу, що описує будь-яке з’єднання цього класу:
- C n h 2n+2.
Це загальна формула парафінових вуглеводнів. Сукупність усіх можливих формул для них становить гомологічний ряд. Різниця між двома найближчими членами ряду становить (-CH2-).