Будова алканів
Всі чотири у зв’язку атома вуглецю – ковалентні сигма-зв’язку. Для утворення кожної з них вуглець використовує одну зі своїх чотирьох орбіталей на зовнішньому енергетичному рівні – 3s (одна штука), 3p (три штуки). Очікується, що раз у зв’язуванні беруть участь різні типи орбіталей, то й отримані зв’язку за своїми енергетичними характеристиками повинні бути різними. Однак такого не спостерігається – в молекулі метану всі чотири однакові.
Для пояснення цього явища використовується теорія гібридизації. Вона працює наступним чином: приймається, що ковалентний зв’язок – це як би два електрона (по одному від кожного атома у парі), що знаходяться рівно між зв’язаними атомами. У метані, наприклад, чотири таких зв’язку, тому чотири пари електронів в молекулі будуть відштовхуватись один від одного. Щоб мінімізувати це постійне штовхання, центральний атом у метані має в своєму розпорядженні всі чотири своїх зв’язки таким чином, щоб вони були якомога далі один від одного. При цьому, для ще більшої вигоди, він як би змішує всі свої орбіталі (3s – 3p – три), роблячи з них потім чотири нові однакові sp3-гібридні орбіталі. У підсумку “кінці” ковалентних зв’язків, на яких розташовані атоми водню, утворюють правильний тетраедр, в середині якого знаходиться вуглець. Такий фінт вухами називається sp3-гібридизацією.
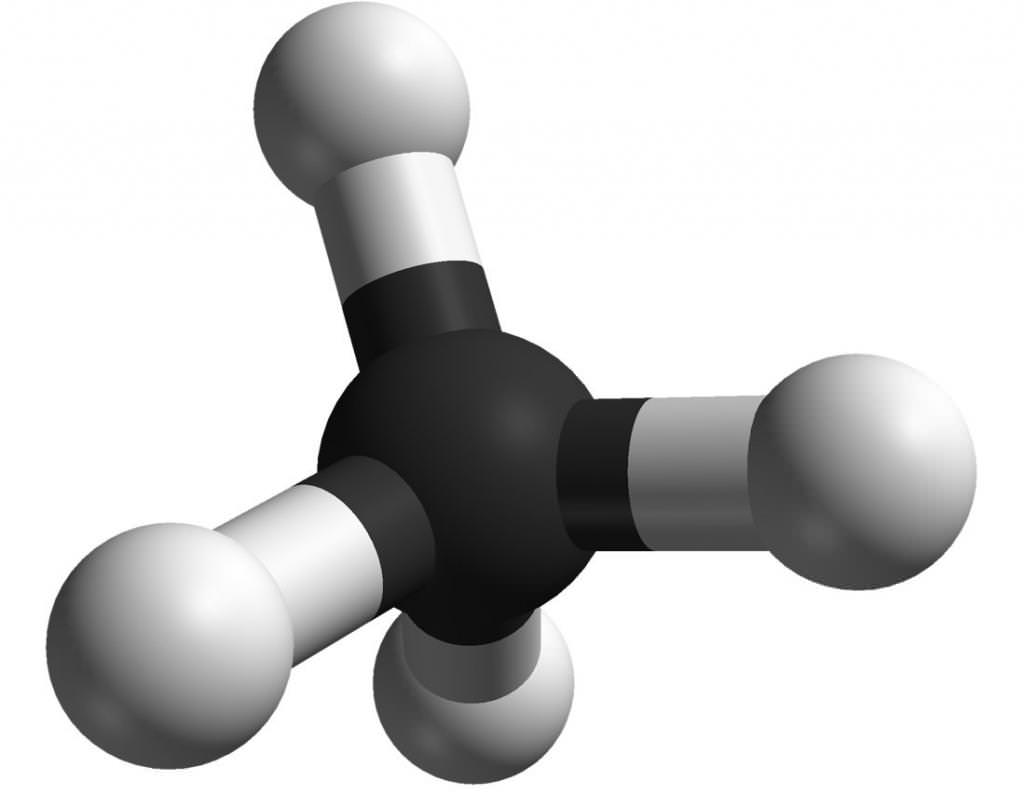
Всі атоми вуглецю в алканах знаходяться в sp3-гібридизації.