При отриманні в промисловості різного виду алкілбензолів і ацилбензолов широке поширення одержала реакція Фріделя‒Крафтса. Вона є одним з двох відомих способів синтезу даних сполук, а її параметри піддаються регулюванню для досягнення більш високого виходу продукту.
Докладніше про способи алкілування аренів
Найвідомішим прикладом реакції Фріделя‒Крафтса є взаємодія хлористого метилу (CH3Cl) з бензолом (C6H6) в присутності хлористого алюмінію (AlCl3), де на виході отримують толуол (C7H9). Цю реакцію отримали в 1877 р. двоє вчених – Чарльз Фрідель і Джеймс Крафтс. Вона згодом стала однією з важливих складових для промислового виробництва алкіларенов.
Основним синтезом є взаємодія бензолу та його гомологів з будь-якими алкілгалогенідамі в присутності так званих кислот Льюїса. Суть від зміни реагентів не змінюється: реакція завжди проходить за одним і тим же принципом. Похідними цього способу стало отримання в органічній хімії алкілбензолів шляхом взаємодії спирту та неорганічної кислоти, карбониевого іона і ароматичного кільця.
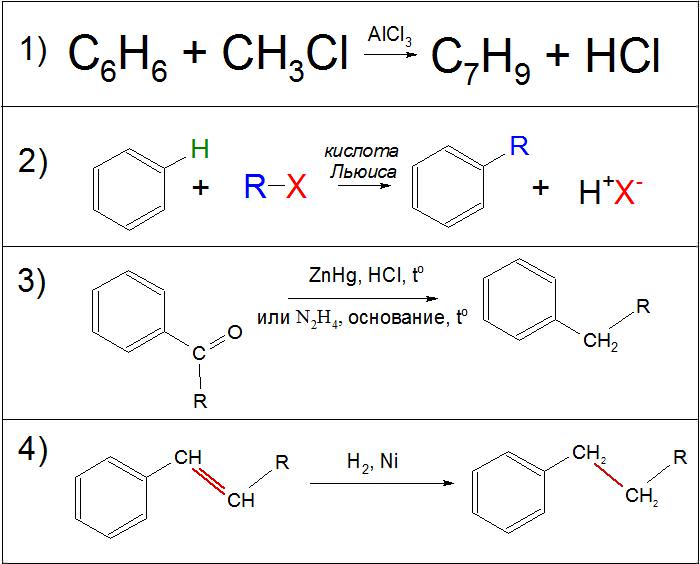
Другим способом вважають метод перетворення бічного ланцюга різних ароматичних кетонів в присутності амальгами цинку (ZnHg) з соляною кислотою (HCl) або гідразину (N2H2) з сильною основою. Обидві реакції носять відновний характер: перша називається реакцією Клемменсу, друга – за Кижнеру‒Вольфу.
Також якщо в бічний ланцюга знаходяться ненасичені зв’язки, їх можна відновити шляхом реакції на нікелевому каталізаторі (Ni) в присутності газоподібного водню (H2).