Методи знаходження молекулярної маси білка бувають хімічними, фізико-хімічними і фізичними. Найпоширенішими фізико-хімічними методами є гель-хроматографія (як колоночная, так і тонкошарова) та електрофорез в середовищі поліакриламідного гелю в присутності додецилсульфату натрію. Вони не вимагають складного обладнання та великих кількостей досліджуваного матеріалу.
Характеристика білків
Білки являють собою високомолекулярні полімери біологічного походження. Вони складаються з амінокислот, сполучених послідовно пептидними зв’язками. Розміри білків залежать від кількості цих самих амінокислот. Середні значення елементного складу білків в %:
- вуглецю – в інтервалі 50,6-54,5;
- кисню – в межах 21,5-23,5;
- азоту – близько 15,0-17,6;
- водню –в інтервалі 6,5-7,3;
- сірки – в межах 0,3-2,5;
- мінеральних речовин – не більше 0,5.
Білки поділяють на прості, що складаються тільки із залишків амінокислот, і складні, що включають простетические групи. Небелковые компоненти можуть бути вуглеводами, ліпідами, нуклеїновими кислотами, похідними вітамінів, іонами металів, гемом і ін Розрізняють чотири структури білків.
Амінокислотний склад білків знаходять шляхом кислотного гідролізу, поєднаної із наступним поділом звільнилися амінокислот за допомогою іонообмінної хроматографії.
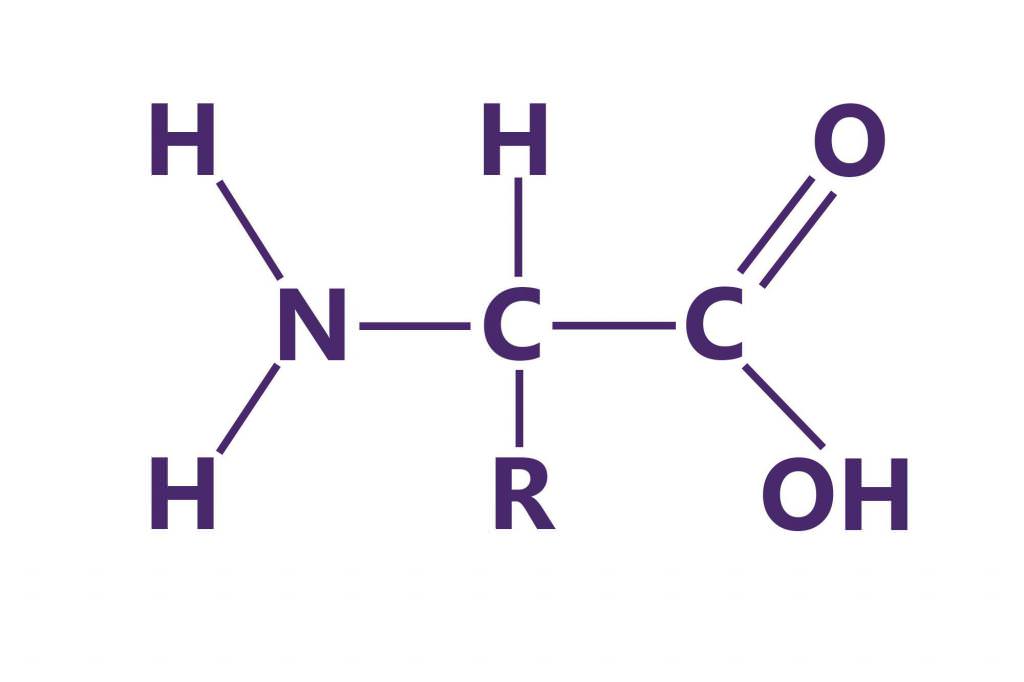
Кількісні показники кожної з амінокислот визначають нін-гидриновым методом. Виявлення розміщення амінокислот у молекулі білка здійснюють шляхом послідовного відщеплення кінцевих амінокислот з допомогою ферментів та їх ідентифікацією, що дозволяє визначити структуру білкової молекули. Ідентифікація заснована на їх різних фізико-хімічних властивостях. Нерідко для цього використовують кольорові реакції на ті або інші амінокислоти та хроматографію.