Кисле середовище
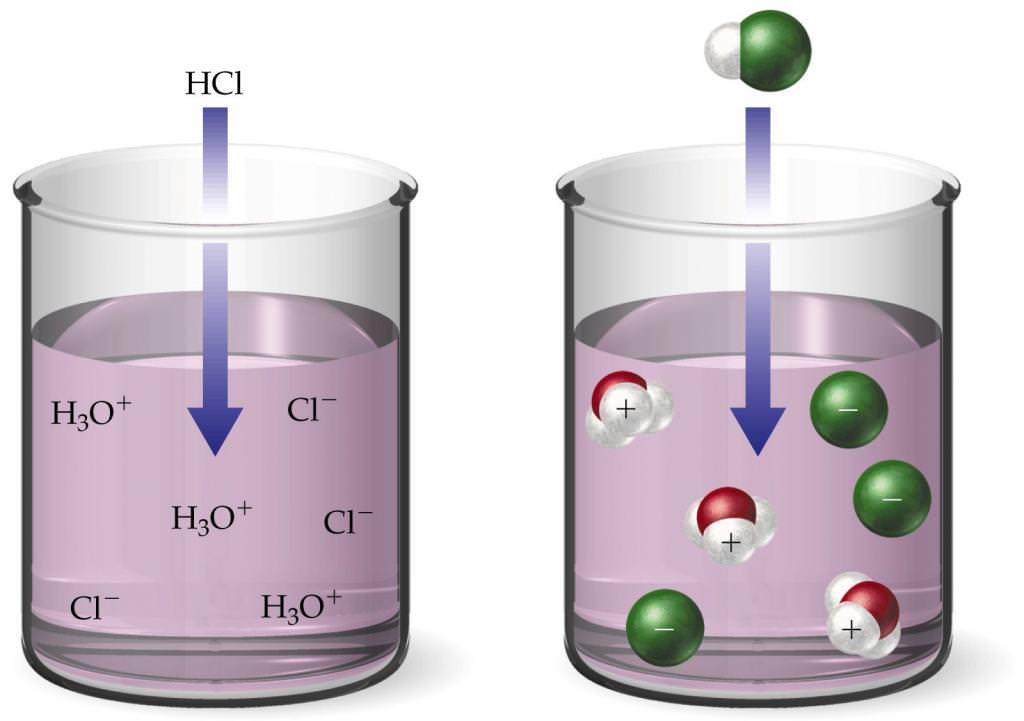
Всі сильні кислоти у воді дисоціюють незворотнім чином. Так, соляна кислота повністю розпадається на катіони Η+ і хлорид-аніони Cl-: ΗCl = Η++ Cl-. Якщо у воду об’ємом 1 л додали 1ˑ10-2 моль ΗCl, то і концентрація іонів Η+ також буде дорівнює 1.10-2 моль. Тобто для такого розчину водневий показник дорівнює 2.
Слабкі кислоти дисоціюють зворотній, тобто, як і у випадку з водою, частина протилежно заряджених іонів знову з’єднується в молекули кислоти. Наприклад, вугільна кислота розпадається на наступні іони: Η2CO3 Η++ ΗCO3-. Мало того, що далеко не всі молекули дисоціюють, так ще й розпалися знову утворюють єдине ціле. Тому для знаходження водневого показника кислот використовують константу дисоціації.
Крім того, за рН розчину можна побічно оцінити силу кислоти: чим вона більше, тим нижче значення рН.