Характеристика азоту
Саме цим хімічним елементом починається підгрупа азоту. Загальна характеристика даного елемента повинна починатися з того, що він проявляє яскраво виражені неметалічні властивості. Тільки азот не здатний збільшувати свої валентності. У нього сім електронів, які розташовуються на двох енергетичних рівнях. На зовнішньому рівні розташовується п’ять електронів, тому азот здатний виявляти наступні ступені окислення: – 3,+5,-2,-1,+1,+2,+3,+4.
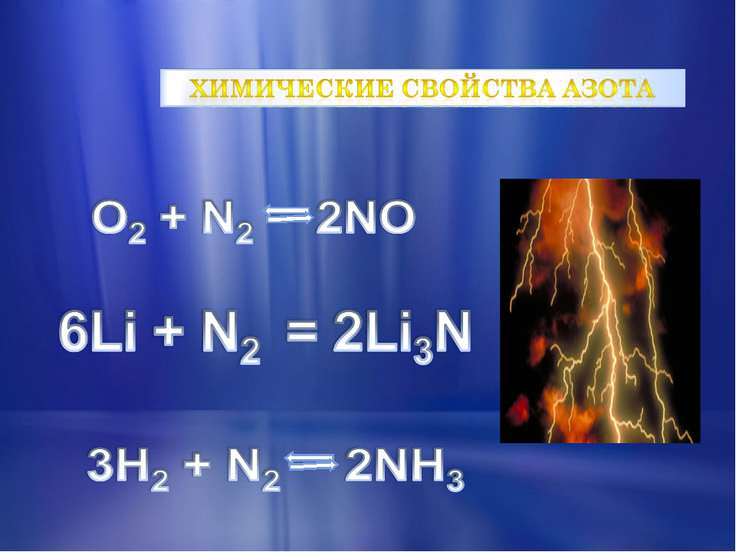
При нормальних умовах азот є молекулярним, малоактивним, газоподібною речовиною. Ця двухатомная молекула не вступає в реакцію з киснем, трохи легший за повітря. При стисненні азот перетворюється в снегообразную масу. Даний газ не підтримує горіння, дихання. При кімнатній температурі він здатний взаємодіяти лише з літієм, утворюючи його нітрид.
Щоб розірвати молекулу азоту, потрібно витратити 942 кДж/моль енергії. Всі хімічні взаємодії, учасником яких стає молекулярний азот, пов’язані із зміною ступенів окиснення, причому азот здатний виявляти властивості і відновника, і окислювача.
При нагріванні він здатний взаємодіяти з металами. При високій температурі реагує з деякими неметалами.
Якби азот вступав у взаємодії при кімнатній температурі, він би утворював з киснем повітря оксиди, що зробило б неможливим існування на землі живих організмів.